
| A. | 氨水加水稀释后,溶液中c (NH3•H2O)/c (NH4+)的值减小,c (H+)增大 | |
| B. | 因为合金在潮湿的空气中易形成原电池,所以合金耐腐蚀性都较差 | |
| C. | 相同条件下,溶液中Fe3+、Cu2+、Zn2+的氧化性依次增强 | |
| D. | 加热蒸干氯化铝溶液并灼烧残留物至质量不变,所得固体为氧化铝 |
分析 A、氨水加水稀释其电离平衡正向移动,溶液碱性减弱;
B、形成原电池能够加快金属腐蚀速率;
C、Fe3+的氧化性比Cu2+强;
D、氯化铝溶液中水解生成氢氧化铝和氯化氢,氯化氢挥发.
解答 解:A、氨水加水稀释其电离平衡正向移动,n (NH3•H2O)减小,n(NH4+)增大,所以$\frac{c(N{H}_{3}•{H}_{2}O)}{c(N{{H}_{4}}^{+})}$减小,故A正确;
B、因为合金在潮湿的空气中易形成原电池,形成原电池能够加快金属腐蚀速率,所以合金耐腐蚀性都较强,故B错误;
C、相同条件下,溶液中Fe3+、Cu2+、Zn2+的氧化性依次减弱,故C错误;
D、氯化铝溶液中水解生成氢氧化铝和氯化氢,加热蒸干氯化铝溶液并灼烧,氯化氢挥发得到水解产物氢氧化铝灼烧得到氧化铝,故D正确;
故选AD.
点评 本题考查了氨水加水稀释时各离子浓度变化、金属腐蚀与原电池关系、离子氧化性比较、盐溶液蒸干灼烧产物判断,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 乙烯的结构简式是C2H4 | |
| B. | 氯离子的结构示意图: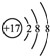 | |
| C. | NaCl的电子式是Na:Cl | |
| D. | 硫酸的电离方程式:H2SO4═H2++SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
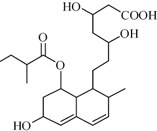 M是一种调节血脂的药物,其结构如图所示(未表示出其空间构型).下列关于M的性质描述不正确的是( )
M是一种调节血脂的药物,其结构如图所示(未表示出其空间构型).下列关于M的性质描述不正确的是( )| A. | M不能与FeCl3溶液发生显色反应 | |
| B. | 0.1mol M足量的Na反应可产生4.48LH2 | |
| C. | M能发生加成、取代、消去反应 | |
| D. | 1mol该物质最多可与2molNaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中性溶液中:Fe3+、K+、Cl-、SO42- | |
| B. | 在澄清透明溶液中:NH4+、Cu2+、Cl-、SO42- | |
| C. | 酸性溶液中:Na+、K+、ClO-、NO3- | |
| D. | 0.1 mol•L-1 KMnO4溶液:Na+、K+、Cl-、SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氨气是一种重要的化工原料,在工农业中都有广泛的应用.
氨气是一种重要的化工原料,在工农业中都有广泛的应用.| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡气体总浓度 (10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com