
(12分)请根据以下信息回答问题:

(1)写出下列物质的化学式:B 、C 、F 、H 、
甲 、乙 。
(2)按要求书写下列方程式
反应⑧的离子方程式
反应⑤的离子方程式
反应⑥的化学方程式
 特高级教师点拨系列答案
特高级教师点拨系列答案科目:高中化学 来源: 题型:
| a2b2-5a1b1 |
| 2b0 |
| a2b2-5a1b1 |
| 2b0 |
查看答案和解析>>
科目:高中化学 来源:2014届吉林省高二下学期第一次月考化学试卷(解析版) 题型:填空题
(10分)第一电离能I1是指气态原子X(g)处于基态时,失去一个电子成为气态阳离子X+(g)所需的能量。下图是部分元素原子的第一电离能I1随原子序数变化的曲线图(其中12号至17号元素的有关数据缺失)。
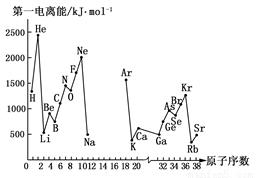
请回答以下问题:
(1)认真分析上图中同周期元素第一电离能的变化规律,推断Na~Ar元素中,Al的第一电离能的大小(最小)范围为________<Al<________(填元素符号)。
(2)从上图分析可知,同一主族元素原子的第一电离能I1变化规律是________。
(3)上图中第一电离能最小的元素在周期表中的位置是________。
(4)根据对角线规则,Be、Al元素最高氧化物的水化物性质相似,它们都具有________,
查看答案和解析>>
科目:高中化学 来源:2013届宁夏高二下学期期末考试化学试卷(解析版) 题型:填空题
(每空2分,共12分)键能的大小可以衡量化学键的强弱,也可以用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。参考以下表格的键能数据,回答下列问题:
|
化学键 |
Si—O |
Si—Cl |
H—H |
H—Cl |
Si—Si |
Si—C |
|
键能/kJ·mol-1 |
460 |
360 |
436 |
431 |
176 |
347 |
(1)比较下列两组物质的熔点高低(填“>”或“<”)
SiC Si; SiCl4 SiO2
(2)能不能根据键能的数据判断单质Si 和化合物SiCl4的熔点高低? (填“能”或“不能”),原因是 。
(3)如图立方体中心的“· ”表示金刚石晶体中的一个原子,请在立方体的顶点用“· ”表示出与之紧邻的碳原子
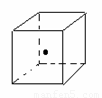
(4)工业上高纯硅可通过下列反应制取:SiCl4(g) + 2H2(g) 高温 Si(s)+4HCl(g)
计算该反应的反应热△H为__________________。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年浙江省高三10月份月考化学试卷 题型:实验题
(12分) 由几种盐溶于水中形成的一瓶澄清的溶液,其中可能含有NH4+、Na+、Mg2+、Ba2+、Al3+、Fe3+、Cu2+、Cl-、Br-、I-、NO3-、CO32-、SO32-、SO42-中的几种。取该溶液进行以下实验:
(1)用pH试纸检验,pH试纸呈红色。排除 离子的存在。
(2)取出部分溶液,加入少量CCl4及几滴新制氯水,经振荡CCl4层呈紫红色。排除
离子存在。
(3)另取部分溶液,逐渐向其中加入NaOH溶液,使溶液从酸性逐渐变为碱性,在滴加过程中和滴加完毕后,均无沉淀产生。则可排除 离子的存在。
(4)另取部分上述碱性溶液,向其中加入Na2CO3溶液,有白色沉淀生成。证明
离子存在,又排除 离子存在。
(5)根据上述实验事实能否确定NH4+是否存在,若能,请简述理由 ,若不能,请简述检验它的方法 。
(6)原溶液一定存在的离子有 ,不能确定的离子有 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com