
【题目】化学与人类生活密切相关。请按要求,回答下列问题:
(1)K2FeO4是一种重要的净水剂,可用下列方法制得:2Fe(OH)3 + 3Cl2 +10KOH![]() 2 K2FeO4 + 6KCl +8H2O在该反应中,还原剂是____________,当反应中有1mol K2FeO4生成时,消耗的Cl2在标况下的体积为____________L,转移电子的数目为____________。
2 K2FeO4 + 6KCl +8H2O在该反应中,还原剂是____________,当反应中有1mol K2FeO4生成时,消耗的Cl2在标况下的体积为____________L,转移电子的数目为____________。
(2)宇航员常用过氧化钠作供氧剂,写出过氧化钠与二氧化碳反应的化学方程式并用双线桥法表示电子转移的方向和数目:_____________________________________________。
(3)厨房里小苏打常作面包和糕点的发泡剂,写出小苏打溶于水的电离方程式:_____。
(4)工业上制漂白粉的化学方程式为________________________________,新制氯水在阳光照射下产生无色气体,该反应的化学方程式是_________________________。
(5)KAl(SO4)2·12H2O因其溶于水生成_____(化学式)可以吸附杂质,从而达到净水作用。
(6)硅酸钠水溶液的俗名为__________,可作为木材_______________的原料。
【答案】Fe(OH)3 33.6 3NA或1.806×1024 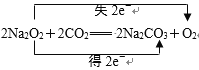 NaHCO3 = Na++HCO3- 2Cl2+2Ca(OH)2= CaCl2+Ca(ClO)2+2H2O 2HClO
NaHCO3 = Na++HCO3- 2Cl2+2Ca(OH)2= CaCl2+Ca(ClO)2+2H2O 2HClO![]() 2HCl +O2↑ Al(OH)3 水玻璃 防火剂
2HCl +O2↑ Al(OH)3 水玻璃 防火剂
【解析】
(1)首先可以判断出高铁酸钾中的铁是+6价,根据方程式可以看出该反应中铁的化合价升高,因此![]() 为还原剂;该反应中每生成2mol高铁酸钾就要消耗3mol氯气,并转移6mol电子,因此当生成1mol高铁酸钾时消耗1.5mol氯气,转移3mol电子,这些氯气在标况下的体积为
为还原剂;该反应中每生成2mol高铁酸钾就要消耗3mol氯气,并转移6mol电子,因此当生成1mol高铁酸钾时消耗1.5mol氯气,转移3mol电子,这些氯气在标况下的体积为![]() L;
L;
(2)该反应是氧元素的歧化反应,一部分氧的化合价升高到0价变为氧气,另一部分氧的化合价降低到-2价变为碳酸钠中的氧,据此来标双线桥即可;
(3)小苏打是盐,盐在水中完全电离用“=”来表示,碳酸是一种弱酸,弱酸酸式盐中的氢是不能完全电离的,因此要写成![]() 的形式;
的形式;
(4)工业制漂白粉的方法是将氯气通入石灰乳中,注意这里只有氯气的化合价发生改变,生成等物质的量的![]() 和
和![]() ;新制氯水在光照下,其中的次氯酸会分解变成氯化氢和氧气,注意不要漏写反应条件;
;新制氯水在光照下,其中的次氯酸会分解变成氯化氢和氧气,注意不要漏写反应条件;
(5)明矾净水的原理是其溶于水后产生的![]() 可以水解变成
可以水解变成![]() 胶体,胶体具有吸附性,因此可以净水;
胶体,胶体具有吸附性,因此可以净水;
(6)硅酸钠的水溶液又名水玻璃,注意这里只能是水溶液,硅酸钠的固体是不能称为水玻璃的,可以用来作木材防火剂的原料。


 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:
【题目】在200 mL含Mg2+、Al3+、NH4+、H+、Cl-等离子的溶液中,逐滴加入5molL-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示。
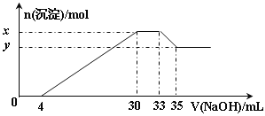
下列叙述不正确的是( )
A.原溶液中c(Cl-)=0.75 mol·L-1
B.x与y的差值为0.01 mol
C.原溶液的pH=1
D.原溶液中n(Mg2+):n(Al3+)=10:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修5:有机化学基础]
甲叉琥珀酸,又名亚甲基丁二酸,在精细化工领域有着广泛的用途,其合成路线如下:
已知:![]()
回答下列问题:
(1)甲叉琥珀酸中官能团的名称为_______,_______。
(2)A的名称为_______,A→B的化学方程式为_______。
(3)B→C的化学方程式为_______,C→D的反应类型为_______。
(4)F的结构简式为_______。
(5)甲叉琥珀酸的同分异构体M也是不饱和二元羧酸,则M共有 _______种(不考虑立体异构),其中核磁共振氢谱显示三组峰,且峰面积之比为3∶1∶2的结构简式为 _______。
(6)根据上述信息,写出用一氯甲苯(![]() CH2Cl)为原料(无机试剂任选)制备苯乙酸(
CH2Cl)为原料(无机试剂任选)制备苯乙酸(![]() CH2COOH)的合成路线_______。
CH2COOH)的合成路线_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】几种短周期元素的原子半径和主要化合价见下表,下列说法中正确的是( )
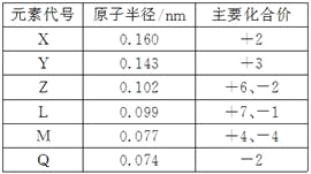
A. 等物质的量的X、Y的单质与足量的盐酸反应,生成的H2一样多
B. Y与Q形成的化合物不能跟氢氧化钠溶液反应
C. Z的氢化物的稳定性强于L的氢化物的稳定性
D. 在化学反应中,M原子与其他原子易形成共价键而不易形成离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将CO2气体缓缓通入到含有等物质的量的KOH、Ba(OH)2和KAlO2的混合溶液中,直至过量,生成的沉淀的物质的量与所通CO2的体积关系如图所示(假设每步反应均完全)。下列关于整个反应进程中的各种描述不正确的是
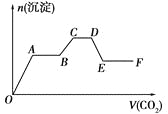
A.A→B段与C→D段所发生的反应相同
B.B→C段反应的离子方程式是:2AlO2―+3H2O+CO2=2Al(OH)3↓+CO32―
C.O→A段反应的化学方程式是:Ba(OH)2+CO2=BaCO3↓+H2O
D.D→E段沉淀的减少是由于碳酸钡固体的消失所致
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅是无机非金属材料的主角,硅的氧化物和硅酸盐约占地壳质量的90%以上。
(1)下列物质不属于硅酸盐的是______。
A.陶瓷 B.玻璃 C.水泥 D.生石灰
(2)SiO2是玻璃的主要成分之一,SiO2与氢氧化钠溶液反应的化学方程式为_____,工艺师常用_____(填物质名称)来雕刻玻璃。
(3)用Na2SiO3水溶液浸泡过的棉花不易燃烧,说明Na2SiO3可用作______。Na2SiO3可通过SiO2与纯碱混合高温熔融反应制得,高温熔融纯碱时下列坩埚可选用的是_____。
A.普通玻璃坩埚 B.石英玻璃坩埚 C.氧化铝坩埚 D.铁坩埚
(4)工业上常利用反应2C+SiO2![]() Si+2CO↑制备硅单质,该反应中所含元素化合价升高的物质是_____(填化学式,下同),氧化剂是_____。
Si+2CO↑制备硅单质,该反应中所含元素化合价升高的物质是_____(填化学式,下同),氧化剂是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是应用广泛的金属。以铝土矿(主要成分为Al2O3,含SiO2和Fe2O3等杂质)为原料制备铝的一种工艺流程如下:
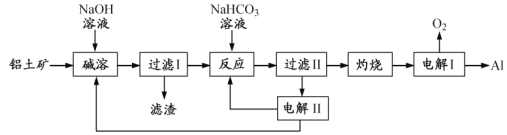
注:SiO2在“碱溶”时转化为铝硅酸钠沉淀。
(1)“碱溶”时生成偏铝酸钠的离子方程式为_____________________。
(2)向“过滤Ⅰ”所得滤液中加入NaHCO3溶液,溶液的pH_________ (填“增大”、“不变”或“减小”)。
(3)“电解Ⅰ”是电解熔融Al2O3,电解过程中作阳极的石墨易消耗,原因是___________。
(4)“电解Ⅱ”是电解Na2CO3溶液,原理如图所示。阳极的电极反应式为_____________________,阴极产生的物质A的化学式为____________。
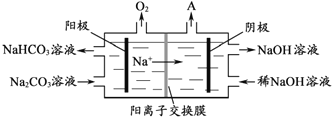
(5)铝粉在1000℃时可与N2反应制备AlN。在铝粉中添加少量NH4Cl固体并充分混合,有利于AlN的制备,其主要原因是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某调香剂的分子式为C12H14O2,该调香剂广泛用于制作香精。某实验室科研人员设计了下列合成路线合成该调香剂。
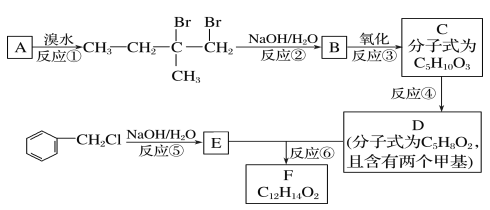
试回答下列问题:
(1)B物质的分子式为____,其分子中有____种不同类型的氢原子。
(2)D物质的官能团名称是____。
(3)上述合成路线中属于取代反应的是____(填编号)。
(4)写出反应③、⑥的化学方程式:
③______,
⑥______。
(5)F有多种同分异构体,符合下列条件的同分异构体共有___种,写出其中一种的结构简式:__。
①属于芳香族化合物,且含有与F相同的官能团;
②苯环上有两个取代基,且苯环上的一氯代物只有两种;
其中一个取代基为—CH2COOCH3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学是一门以实验为基础的学科。回答下列问题:
(1)认识仪器是正确使用仪器的前提。

写出上述仪器的名称:A___________;B__________;C_________。
(2)实验室利用胆矾晶体和烧碱制备氧化铜固体时,其实验操作如下:
Ⅰ.混合 Ⅱ.过滤 Ⅲ.加热分解 Ⅳ.溶解 Ⅴ.洗涤
就此实验完成下列填空:
①正确的操作步骤是______________(填罗马数字)。
②操作Ⅱ中用到的玻璃仪器除烧杯、玻璃棒外,还需要用到上述仪器中的________(填字母)。
③在实验中多次用到玻璃棒,其作用有三个,分别是______、_______和转移。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com