
| 分类标准 | 电解质 | 盐 | 非电解质 | 混合物 |
| 属于该类 的物质 |
分析 (1)水溶液中或熔融状态下能够导电的化合物称为电解质;在上述两种情况下都不能导电的化合物称为非电解质,蔗糖、乙醇等都是非电解质.大多数的有机物都是非电解质;单质,混合物既不是电解质也不是非电解质;盐是指由金属离子和酸根离子构成的化合物,是纯净物;
(2)碘化钾溶液在空气中被氧化生成碘、氢氧化钾,据此解答.
解答 解:(1)①③⑤⑥⑨都是在水溶液或者熔融状态下能导电的化合物,属于电解质;
④在水溶液和熔融状态下都不导电的化合物,是非电解质;
⑦⑧都是由不同种分子构成,属于混合物;
①⑤⑨都是由金属离子和酸根离子构成的化合物,属于盐;
②铜是单质,属于纯净物,不是盐,既不是电解质也不是非电解质;
故答案为:①③⑤⑥⑨;①⑤⑨;④;⑦⑧;
(2)碘化钾溶液在空气中被氧化的离子方程式为:O2+4I-+2H2O═2I2+4OH-,故答案为:O2+4I-+2H2O═2I2+4OH-.
点评 本题主要考查了物质的分类和离子方程式的书写,难度不大,准确理解电解质、非电解质、盐、化合物的概念是解题的关键.


科目:高中化学 来源: 题型:选择题
| A. | Na、Mg、Al最外层电子数依次增多,单核离子的氧化性依次增强 | |
| B. | P、S、Cl最高正化合价依次升高,对应气态氢化物的稳定性依次增强 | |
| C. | 同周期元素的原子半径以第ⅦA族的为最大 | |
| D. | Na、Mg、Al的氢氧化物的碱性依次减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 时间(h) 物质的量(mol) | 0 | 2 | 4 | 6 |
| N2 | 1.50 | 1.20 | 1.00 | 1.00 |
| H2 | 4.50 | 3.60 | 3.00 | 3.00 |
| NH3 | 0 | m | 1.00 | 1.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 发生氧化反应的为负极 | B. | 正极为电子流入的一极 | ||
| C. | 比较不活泼的金属为负极 | D. | 电流的方向由正极到负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
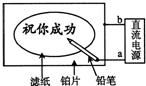 某学生设计了一个“黑笔写红字”的趣味实验.滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹.据此,下列叙述正确的是( )
某学生设计了一个“黑笔写红字”的趣味实验.滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹.据此,下列叙述正确的是( )| A. | 铅笔端作阳极,发生氧化反应 | B. | 铂片端作阴极,发生还原反应 | ||
| C. | 铅笔端有少量的氯气产生 | D. | a点是负极,b点是正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com