
| A. | ①②③ | B. | ①②③④ | C. | ②③ | D. | ②③④ |
分析 影响化学反应速率的因素有温度、浓度、压强、催化剂、x射线、固体物质的表面积等.浓度:增加反应物浓度,使反应速率加快.温度:升高温度,使反应速率加快.压强:对于有气体参与的化学反应,除体积其它条件不变时,增大压强,使反应速率加快.使用正催化剂,使反应物速率加快,以此来解答.
解答 解:①C为纯固体,增加反应物C的用量,反应速率不变,故不选;
②升高反应体系的温度,活化分子百分数增多,反应速率一定加快,故选;
③容器不变再通入CO2,反应物浓度增大,正反应速率加快,故选;
④缩小反应体系的体积,压强增大,则正逆反应速率均增大,故选;
故选D.
点评 本题考查影响化学反应速率的因素,注意压强、反应物的用量与反应中物质的状态之间的关系,题目难度不大.


 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源: 题型:选择题
| A. | 四氯化碳、乙醇、苯、乙酸 | B. | 苯、甲苯、己烯、己烷 | ||
| C. | 苯、己烯、溴苯、氯化钠溶液 | D. | 乙酸、乙醇、硝基苯、乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠与水反应:Na+H2O═Na++OH-+H2↑ | |
| B. | 氯气与水反应:Cl2+H2O═2H++Cl-+ClO- | |
| C. | 过量的NaHSO4与Ba(OH)2溶液反应:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O | |
| D. | 用氯化铁溶液腐蚀电路板:Fe3++Cu═Fe2++Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
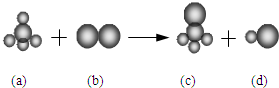 已知由三种元素构成的四种物质存在下列反应,其中a的分子空间构型为正四面体.组成a分子的两种元素的原子序数和小于10,组成b分子的元素为第三周期的元素.则下列判断正确的是( )
已知由三种元素构成的四种物质存在下列反应,其中a的分子空间构型为正四面体.组成a分子的两种元素的原子序数和小于10,组成b分子的元素为第三周期的元素.则下列判断正确的是( )| A. | 四种分子中的化学键均是极性键 | B. | a、c分子中中心原子均为sp3杂化 | ||
| C. | 四种分子中既有σ键,又有π键 | D. | b、d分子中共价键的键能b大于d |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 滴定次数 | 待测液(mL) | 0.6000mol/L盐酸溶液的体积(mL) | |
| 初读数 | 终读数 | ||
| 第一次 | 20.00 | 1.00 | 21.00 |
| 第二次 | 20.00 | 如右图Ⅰ | 如右图Ⅱ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
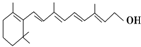 ,关于它的正确说法是( )
,关于它的正确说法是( )| A. | 维生素A分子式为C20H30O | |
| B. | 维生素A是一种易溶于水的醇 | |
| C. | 维生素A不易被氧化 | |
| D. | 1 mol维生素A最多可以和6 mol氢气加成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
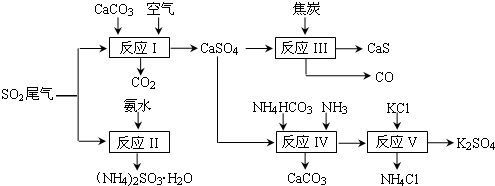
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

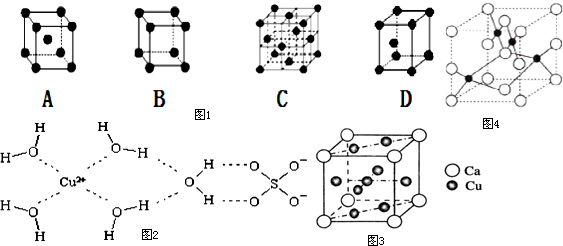
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com