
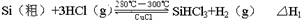
| 物质 | BCl3 | PCl3 | SiCl4 | AsCl3 | AlCl3 | SiHCl3 |
| 沸点 | 12.1 | 73.5 | 57.0 | 129.4 | 180(升华) | 31.2 |



科目:高中化学 来源:不详 题型:单选题
| A.2molSO2(g)和1molO2(g)所具有的内能小于2molSO3(g)所具有的内能 |
| B.将2molSO2(g)、1molO2(g)置于一密闭容器中充分反应后放出QkJ的热量 |
| C.升高温度,平衡向正反应方向移动,上述热化学方程式中的Q值减小 |
| D.如将一定量SO2(g)和O2(g)置于某密闭容器中充分反应后放热QkJ,则此过程中有2molSO2(g)被氧化 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 xC(g)+D(g)中,已知:反应开始加入的物质只有A、B;起始浓度A为5 mol·L-1,B为3 mol·L-1,前2 min C的平均反应速率为0.5 mol·L-1·min-1。2 min后,测得D的浓度为0.5 mol·L-1。(设反应前后溶液体积不变)则关于此反应的下列说法中正确的是( )
xC(g)+D(g)中,已知:反应开始加入的物质只有A、B;起始浓度A为5 mol·L-1,B为3 mol·L-1,前2 min C的平均反应速率为0.5 mol·L-1·min-1。2 min后,测得D的浓度为0.5 mol·L-1。(设反应前后溶液体积不变)则关于此反应的下列说法中正确的是( )查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
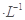 硫酸的烧杯中,此时,Na2S2O3和H2SO4缓慢地进行反应:
硫酸的烧杯中,此时,Na2S2O3和H2SO4缓慢地进行反应: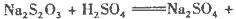
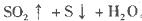 其中最早出现明显浑浊的是
其中最早出现明显浑浊的是A.25  .20 mL 3 mol .20 mL 3 mol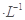 的Na2S2O3溶液,25 mL蒸馏水 的Na2S2O3溶液,25 mL蒸馏水 |
B.0  .30 mL 2 mol .30 mL 2 mol 的Na2S2O3溶液,15 mL蒸馏水 的Na2S2O3溶液,15 mL蒸馏水 |
C.25  .10 mL 4 mol .10 mL 4 mol 的Na2S2O3溶液,35 mL蒸馏水 的Na2S2O3溶液,35 mL蒸馏水 |
D.0  .10 mL 2mol .10 mL 2mol 的Na2S2O3溶液,35 mL蒸馏水 的Na2S2O3溶液,35 mL蒸馏水 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 CO(g)+H2O(g) 反应过程中测定的部分数据见下表(表中t2>t1):
CO(g)+H2O(g) 反应过程中测定的部分数据见下表(表中t2>t1):| 反应时间/min | n(CO2)/mol | H2/ mol |
| 0 | 1.50 | 1.00 |
| t1 | | 0.40 |
| t2 | 0.90 | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
 xC(g)+2D(g),5min后反应达平衡,容器内压强变小,测得D的平均反应速率为0.1mol/(L.min).求:
xC(g)+2D(g),5min后反应达平衡,容器内压强变小,测得D的平均反应速率为0.1mol/(L.min).求:查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 Y(g),温度T1、T2下X的物质的量浓度c(x)随时间t变化的曲线如图所示,下列叙述正确的是
Y(g),温度T1、T2下X的物质的量浓度c(x)随时间t变化的曲线如图所示,下列叙述正确的是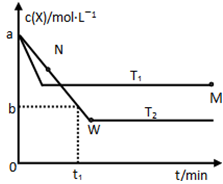
| A.该反应进行到M点放出的热量大于进行到W点放出的热量 |
B.T2下,在0~t1时间内,υ(Y)=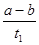 mol/(L·min) mol/(L·min) |
| C.M点的正反应速率υ正大于N点的逆反应速率υ逆 |
| D.M点时再加入一定量的X,平衡后X的转化率减小 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 3Z(g) + W(s) ΔH>0 的叙述正确的是
3Z(g) + W(s) ΔH>0 的叙述正确的是| A.加入少量W,逆反应速率增大,平衡向左移动 |
| B.增大压强,正反应速率增大,逆反应速率减小 |
| C.温度、体积不变,充入He气增大压强,反应速率会加快 |
| D.升高温度,混合气体的平均相对分子质量减小 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2C的反应来说,以下化学反应速率的表示中,反应速率最快的是 ( )
2C的反应来说,以下化学反应速率的表示中,反应速率最快的是 ( )查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com