
分析 因焰色反应为黄色,说明五种物质都含有钠元素,根据钠及其化合物的性质,可推知各物质.E为氯化钠,可燃气体是氢气,B为钠,无色无味气体H能使澄清石灰水变浑浊,则H为二氧化碳,F和H也可反应生成C和另一种无色无味气体,则无色无味气体为氧气,F为过氧化钠,C为碳酸钠,C、D与盐酸反应生成一种无色无味气体H,D和A可反应生成C,则D为碳酸氢钠,A为氢氧化钠,据此回答.
解答 解:(1)因焰色反应为黄色,说明五种物质都含有钠元素,根据钠及其化合物的性质,可推知各物质.E为氯化钠,可燃气体是氢气,B为钠,无色无味气体H能使澄清石灰水变浑浊,则H为二氧化碳,F和H也可反应生成C和另一种无色无味气体,则无色无味气体为氧气,F为过氧化钠,C为碳酸钠,C、D与盐酸反应生成一种无色无味气体H,D和A可反应生成C,则D为碳酸氢钠,A为氢氧化钠,
故答案:NaOH、Na、Na2CO3、NaHCO3、NaCl、Na2O2;
(2)F(过氧化钠)和H(二氧化碳)反应的化学方程式为:2Na2O2+2CO2=2Na2CO3+O2,故答案为:2Na2O2+2CO2=2Na2CO3+O2;
(3)①D(碳酸氢钠)和盐酸之间的反应是:HCO3-+H+=CO2↑+H2O,故答案为:HCO3-+H+=CO2↑+H2O;
②B(金属钠)水之间的反应为:2Na+2H2O=2Na++2OH-+H2↑,故答案为:2Na+2H2O=2Na++2OH-+H2↑.
点评 此题主要考查学生的综合分析能力,不但要求同学们具备有关物质的基础知识,而且要有实验操作的经历和分析、解决化学实验问题的能力.解题时需要认真分析题目给出的条件,联系实际,逐一分析推断.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 鉴别Na2CO3和NaHCO3可用Ba(OH)2或Ca(OH)2溶液 | |
| B. | 除去Na2CO3固体中混有的少量NaHCO3,可采用加热法 | |
| C. | CO2中混有少量HCl、SO2等气体时,可用饱和NaHCO3溶液提纯气体 | |
| D. | 将澄清石灰水滴入NaHCO3溶液中,开始时发生反应的离子方程式为:Ca2++2OH-+2HCO3-═CaCO3↓+CO32-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
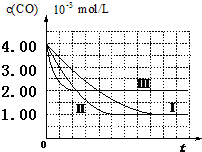 (I)目前,汽车厂商常利用催化技术将尾气中的NO和CO转化成CO2和N2,化学方程式如下:2NO+2CO$\stackrel{催化剂}{?}$2CO2+N2.为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究.
(I)目前,汽车厂商常利用催化技术将尾气中的NO和CO转化成CO2和N2,化学方程式如下:2NO+2CO$\stackrel{催化剂}{?}$2CO2+N2.为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究.| 实验编号 | 实验目的 | T/℃ | NO初始浓度mol/L | CO初始浓度mol/L | 同种催化剂的比表面积m2/g |
| Ⅰ | 为以下实验作参照 | 280 | 6.50×10-3 | 4.00×10-3 | 80 |
| Ⅱ | 探究催化剂比表面积对尾气转化速率的影响 | 6.50×10-3 | 4.00×10-3 | 120 | |
| Ⅲ | 探究温度对尾气转化速率的影响 | 360 | 6.50×10-3 | 4.00×10-3 | 80 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
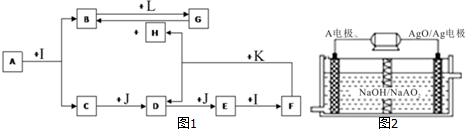
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸氢钠溶液跟过量的饱和石灰水反应 HCO3-+Ca2++OH-═CaCO3↓+2H2O | |
| B. | 向NaHSO4溶液中滴加Ba(OH)2溶液显中性H++SO42-+-+Ba2++OH-═BaSO4↓+H2O | |
| C. | 氯化亚铁溶液中通入氯气 Fe2++Cl2═Fe3++2Cl- | |
| D. | 苛性钾溶液中加入稀盐酸 H++OH-═H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
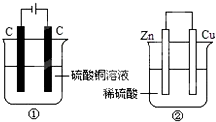 如图两个装置中,液体体积均为200mL,开始工作前电解质溶液的浓度均为0.5mol•L -1,工作一段时间后,测得有0.02mol电子通过,若忽略溶液体积的变化,下列叙述正确的是( )
如图两个装置中,液体体积均为200mL,开始工作前电解质溶液的浓度均为0.5mol•L -1,工作一段时间后,测得有0.02mol电子通过,若忽略溶液体积的变化,下列叙述正确的是( )| A. | 产生气体体积 ①=② | |
| B. | ①中阴极质量增加,②中正极质量减小 | |
| C. | 电极反应式:①中阳极:4OH --4e -═2H2O+O2↑ ②中负极:2H ++2e -═H2↑ | |
| D. | 溶液的pH变化:①减小,②增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
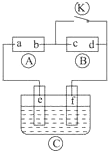 如图
如图  为直流电源,
为直流电源, 为浸透饱和氯化钠溶液和酚酞试液的滤纸,
为浸透饱和氯化钠溶液和酚酞试液的滤纸, 为电镀槽,接通电路后发现
为电镀槽,接通电路后发现 上的c点显红色,为实现铁上镀锌,接通
上的c点显红色,为实现铁上镀锌,接通 后,使c、d两点短路.下列叙述正确的是 ( )
后,使c、d两点短路.下列叙述正确的是 ( )| A. | a为直流电源的负极 | B. | c极发生的反应为2H++2e═-H2↑ | ||
| C. | f电极为锌板 | D. | e极发生还原反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com