
【题目】海水是一个巨大的化学资源宝库.利用海水可以获得许许多多化工产品。
(1)由海水经过晾硒可制得粗盐.实验室去除掉粗盐中的泥沙所需的玻璃仪器有_________________。
(2)利用制盐后的盐卤提取溴的工艺流程如下(部分操作和条件已略去):

①溶液I→Br2的离子方程式为:Br-+BrO3-+H+→Br2+H2O(未配平),反应中氧化产物和还原产物的质量之比为____________。
②上图中低浓度尽Br2加Na2CO3,、H2SO4处理的目的是____________。
(3)盐卤蒸发冷却后析出卤块的主要成分是MgCl2此外还含Fe2+、Fe3+、Mn2+等离子,以卤块为原料制得镁的工艺流程如下(部分操作和条件巳略去)

巳知生成氢氧化物沉淀的pH如下.
沉淀物 | Fe(OH)2 | Fe(OH)3 | Mn(OH)2 | Mg(OH)2 |
开始沉淀 | 7.6 | 2.7 | 8.3 | 9.6 |
沉淀完全 | 9.6 | 3.7 | 9.8 | 11.1 |
①步骤②中需控制pH=9.8,其目的是____________________________________。
②NaClO还能除去盐卤中的尿素[CO (NH2)2],生成盐类物质和能参与大气循环的物质,其反应原理___________(用化学方程式表示),请你计算,若除去盐卤中含有的0.1 molCO (NH2)2时需消耗NaClO_____g。
【答案】 漏斗、玻璃棒、烧杯 5:1 Br2的富集 使Fe2+、Fe3+、Mn2+完全转化为沉淀而除去 CO (NH2) 2+3NaClO=N2↑+3NaCl+CO2↑+2H2O 22. 35
【解析】(1)实验室去除掉粗盐中的泥沙需要过滤,则所需的玻璃仪器有漏斗、玻璃棒、烧杯;(2)①Br2与Na2CO3反应生成NaBrO3、NaBr和CO2,Br元素部分由0价升高到+5价,另一部分从0价降低到-1价,则根据电子得失守恒可知氧化产物溴化钠和还原产物NaBrO3的物质的量之比为5:1;②低浓度Br2加Na2CO3、H2SO4处理后最终得到高浓度的溴,目的是富集Br2;(3)盐卤加水溶解,加NaClO将Fe2+氧化成Fe3+,然后加入NaOH调节pH为9.8,使Fe2+、Fe3+、Mn2+转化为氢氧化物沉淀,过滤,滤液经过蒸发浓缩、冷却结晶、过滤得到,氯化镁晶体,在HCl气氛中加热得到无水氯化镁,电解熔融的氯化镁得到Mg;①步骤②中需控制pH=9.8在于使除Mg2+以外的各种杂质金属离子都生成氢氧化物沉淀,以便通过过滤而除去,即控制pH=9.8的目的:除去溶液中含有的Fe2+、Fe3+、Mn2+杂质,使之完全生成沉淀而除去;②NaClO还能除去盐卤中的CO(NH2)2,生成盐和能参与大气循环的物质,其反应为3NaClO+CO(NH2)2=3NaCl+CO2↑+N2↑+2H2O,由方程式中物质之间的关系可知,0.1mol CO(NH2)2消耗NaClO为0.3mol,则m(NaClO)=nM=0.3mol×74.5g/mol=22.35g。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】由钠、镁、铝、锌四种金属单质中的两种组成的合金共12 g,跟足量的盐酸反应产生5.6 L氢气(标准状况),那么此合金中一定含有的金属是
A. Na B. Mg C. Al D. Zn
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓度均为0.1mol·L-1的下列溶液,按其pH由小到大的排列顺序是( )
①NaHCO3溶液 ②NaHSO4溶液 ③NaCl溶液 ④AlCl3溶液
A. ①<②<③<④ B. ①<③<④<②
C. ②<④<③<① D. ④<③<②<①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知空气-锌电池的电极反应为锌片:Zn+2OH--2e-=ZnO+H2O;碳棒:O2+2H2O+4e-=4OH-,据此判断
A.锌片负极,被氧化B.锌片负极,被还原
C.石墨正极,被氧化D.石墨正极,被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数依次增加。K、L、M均是由这些元素组成的二元化合物,甲、乙分别是元素X、Y的单质,甲是常见的固体,乙是常见的气体。K 是无色气体,是主要的大气污染物之一。0.05 mol/L丙溶液的pH为1,上述物质的转化关系如图所示。下列说法正确的是
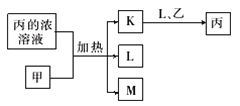
A. K、L、M 中沸点最高的是M
B. 元素的非金属性:Z>Y>X
C. 原子半径:W<X<Y
D. 丙也可由W、Y组成的某化合物与K直接反应制得
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,某饱和氢氧化钠溶液体积为V mL,溶液密度为d g·cm-3,质量分数为w,物质的量浓度为c mol·L-1,溶液中含氢氧化钠的质量为m g,该温度下NaOH的溶解度为S。
(1)用w来表示该温度下氢氧化钠的溶解度(S)为_________________。
(2)用m、V表示溶液中溶质的物质的量浓度(c)为__________________。
(3)用w、d表示溶液中溶质的物质的量浓度(c)为__________________。
(4)用c、d表示溶液中溶质的质量分数(w)为______________________。
(5)用S、d表示溶液中溶质的物质的量浓度(c)为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M是一种新型可生物降解的高分子材料,主要制造可降解纤维、塑料和医用材料,其水解最终产物为N。燃烧9.0 g的N只产生CO2和H2O,且质量分别为13.2 g和5.4 g,实验测得N在标准状况下的蒸气密度为4.02 g/L;N的核磁共振氢谱显示的峰面积之比为 1:1:1: 3
(1)通过计算确定N的分子式。____________
(2)由题知写出N的结构简式,并写出N在催化剂条件下缩聚反应合成M的化学方程式。_________________、__________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaCl是一种化工原料,可以制备一系列物质(如图)。下列说法正确的是

A.25℃,NaHCO3在水中的溶解度比Na2CO3的大
B.石灰乳与Cl2的反应中,Cl2既是氧化剂,又是还原剂
C.常温下干燥的Cl2能用钢瓶贮存,所以Cl2不与铁反应
D.图4所示转化反应都是氧化还原反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com