
【题目】最新研究表明,咖啡中含有的咖啡酸能使人心脑血管更年轻。咖啡酸的球棍模型如图所示,下列有关咖啡酸的叙述不正确的是( )
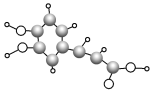
A.咖啡酸的分子式为C9H8O4
B.咖啡酸可以发生氧化反应、消去反应、酯化反应、加聚反应
C.咖啡酸中不含手性碳原子
D.![]() 是咖啡酸的一种同分异构体,1 mol 该物质最多可消耗3 mol NaOH
是咖啡酸的一种同分异构体,1 mol 该物质最多可消耗3 mol NaOH
科目:高中化学 来源: 题型:
【题目】成熟的苹果中含有淀粉、葡萄糖和无机盐等,某课外兴趣小组设计了一组实验证明某些成分的存在,请你参与并协助他们完成相关实验。
(1)用小试管取少量的苹果汁,加入_______(填名称),溶液变蓝,则证明苹果中含有淀粉。
(2)利用含淀粉的物质可以生产醋酸。下面是生产醋酸的流程图,试回答下列问题:
![]()
B是日常生活中有特殊香味的常见有机物,在有些饮料中含有B。
①写出化学方程式,并注明反应类型。
B与醋酸反应:____________________________,属于______________反应。
B→C____________________________,属于____________________________反应。
②可用于检验A的试剂是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于古籍中的记载说法不正确的是
A. 《本草纲目》“烧酒”条目下写道自元时始创其法,用浓酒和糟入甑,蒸令气上其清如水,味极浓烈,盖酒露也”。这里所用的“法”是指蒸馏
B. 《吕氏春秋·别类编》中“金(即铜)柔锡柔,合两柔则刚” 体现了合金硬度方面的特性
C. 《本草经集注》中关于鉴别硝石(KNO3)和朴硝(Na2SO4)的记载:“以火烧之,紫青烟起,乃真硝石也”,该方法应用了显色反应
D. 《抱朴子·金丹篇》中记载:“丹砂(HgS)烧之成水银,积变又成丹砂”,该过程发生了分解、化合、氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】经研究发现白蚁信息素有:![]() (2,4-二甲基-1-庚烯),
(2,4-二甲基-1-庚烯),![]() (3,7-二甲基-1-辛烯),家蚕的性信息素为:CH3(CH2)8CH==CH—CH==CH(CH2)8CH3。下列说法不正确的是
(3,7-二甲基-1-辛烯),家蚕的性信息素为:CH3(CH2)8CH==CH—CH==CH(CH2)8CH3。下列说法不正确的是
A.2,4-二甲基1庚烯的分子式为C9H18
B.2,4-二甲基-1-庚烯与3,7-二甲基-1-辛烯互为同系物
C.以上三种信息素均能使溴的四氯化碳溶液褪色
D.1 mol家蚕的性信息素与1 mol Br2加成,产物只有一种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物M的结构简式为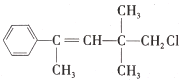 。关于该有机物,下列叙述不正确的是( )
。关于该有机物,下列叙述不正确的是( )
A.M不能与NaOH的醇溶液发生反应
B.1 mol M最多能与4 mol H2发生加成反应
C.M与NaOH溶液共热后,再AgNO3溶液产生白色沉淀
D.M既能使溴水褪色又能使KMnO4酸性溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列四个装置的说明符合实验要求的是( )
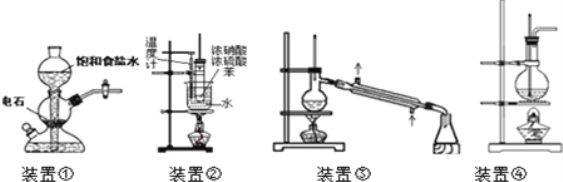
A.装置①:实验室中若需制备较多量的乙炔可用此装置
B.装置②:实验室中可用此装置来制备硝基苯,产物中因混有NO2而显黄色
C.装置③:实验室中直接蒸馏医用酒精制备无水酒精
D.装置④:实验室中可用此装置来制备乙酸乙酯并在烧瓶中获得产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 和
和![]() 是两种重要的温室气体,通过
是两种重要的温室气体,通过![]() 和
和![]() 反应制造更高价值化学品是目前的研究目标。
反应制造更高价值化学品是目前的研究目标。
![]() 时,以镍合金为催化剂,向
时,以镍合金为催化剂,向![]() 容器中通入
容器中通入![]() 、
、![]() ,发生如下反应:
,发生如下反应:![]() 。平衡体系中各组分体积分数如下表:
。平衡体系中各组分体积分数如下表:
物质 |
|
| CO |
|
体积分数 |
|
|
|
|
![]() 此温度下该反应的平衡常数
此温度下该反应的平衡常数![]() __________
__________
![]() 已知:
已知:![]()
![]()
![]()
![]()
![]()
反应![]() 的
的![]() _____________
_____________![]()
![]() 以二氧化钛表面覆盖
以二氧化钛表面覆盖![]() 为催化剂,可以将
为催化剂,可以将![]() 和
和![]() 直接转化成乙酸。
直接转化成乙酸。
![]() 在不同温度下催化剂的催化效率与乙酸的生成速率如图所示。
在不同温度下催化剂的催化效率与乙酸的生成速率如图所示。![]() 时,温度升高而乙酸的生成速率降低的原因是___________。
时,温度升高而乙酸的生成速率降低的原因是___________。
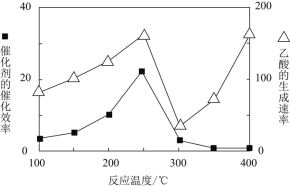
![]() 为了提高该反应中
为了提高该反应中![]() 的转化率,可以采取的措施是_________。
的转化率,可以采取的措施是_________。
![]() 、
、![]() 、MgO均能吸收
、MgO均能吸收![]() ;
;
![]() 如果寻找吸收
如果寻找吸收![]() 的其他物质,下列建议不合理的是______
的其他物质,下列建议不合理的是______
![]() 可在具有强氧化性的物质中寻找
可在具有强氧化性的物质中寻找
![]() 可在碱性氧化物中寻找
可在碱性氧化物中寻找
![]() 可在ⅠA、ⅡA族元素形成的氧化物中寻找
可在ⅠA、ⅡA族元素形成的氧化物中寻找
![]() 吸收
吸收![]() 后,产物用于合成
后,产物用于合成![]() ,
,![]() 用于吸收、释放
用于吸收、释放![]() ,原理是:在
,原理是:在![]() ,
,![]() 与
与![]() 接触后生成
接触后生成![]() ;平衡后加热至
;平衡后加热至![]() ,反应逆向进行,放出
,反应逆向进行,放出![]() ,
,![]() 再生,说明该原理的化学方程式是_____________。
再生,说明该原理的化学方程式是_____________。
![]() 高温电解技术能高效实现下列反应:
高温电解技术能高效实现下列反应: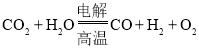 ,其可将释放的
,其可将释放的![]() 转化为具有工业利用价值的产品。工作原理示意图如下:
转化为具有工业利用价值的产品。工作原理示意图如下:
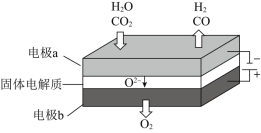
![]() 在电极a放电的电极反应式是____________。
在电极a放电的电极反应式是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S在金属离子的鉴定分析、煤化工等领域都有重要应用。请回答:
Ⅰ.工业上一种制备H2S的方法是在催化剂、高温条件下,用天然气与SO2反应,同时生成两种能参与大气循环的氧化物。
(1)该反应的化学方程式为_____________。
Ⅱ.H2S可用于检测和沉淀金属阳离子。
(2)H2S的第一步电离方程式为________。
(3)已知:25 ℃时,Ksp(SnS)=1.0×10-25,Ksp(CdS)=8.0×10-27。该温度下,向浓度均为0.1 mol·L-1的CdCl2和SnCl2的混合溶液中通入H2S,当Sn2+开始沉淀时,溶液中c(Cd2+)=________(溶液体积变化忽略不计)。
Ⅲ.H2S是煤化工原料气脱硫过程的重要中间体。反应原理为
ⅰ.COS(g)+H2(g) ![]() H2S(g)+CO(g) ΔH=+7 kJ·mol-1;
H2S(g)+CO(g) ΔH=+7 kJ·mol-1;
ⅱ.CO(g)+H2O(g) ![]() CO2(g)+H2(g) ΔH=-42 kJ·mol-1。
CO2(g)+H2(g) ΔH=-42 kJ·mol-1。
(4)已知:断裂1 mol分子中的化学键所需吸收的能量如表所示。
分子 | COS(g) | H2(g) | CO(g) | H2S(g) | H2O(g) | CO2(g) |
能量/(kJ·mol-1) | 1 319 | 442 | x | 678 | 930 | 1 606 |
表中x=________。
(5)向10 L容积不变的密闭容器中充入1 mol COS(g)、1 mol H2(g)和1 mol H2O(g),进行上述两个反应。其他条件不变时,体系内CO的平衡体积分数与温度(T)的关系如图所示。
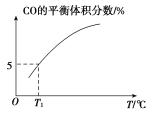
①随着温度升高,CO的平衡体积分数_____(填“增大”或“减小”)。原因为_______
②T1℃时,测得平衡时体系中COS的物质的量为0.80 mol。则该温度下,COS的平衡转化率为_____;反应ⅰ的平衡常数为_____(保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用已知物质的量浓度的HCl来测定未知物质的量浓度的NaOH溶液时,选甲基橙作指示剂,使所测氢氧化钠溶液的浓度偏低的是( )
A.锥形瓶用蒸馏水冲洗后未用待测液润洗
B.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
C.终点时,有一滴标准液挂在滴定管尖嘴处未滴入锥形瓶
D.装标准液的滴定管滴定前尖嘴处有气泡,滴定后气泡消失
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com