
| A. | 在氧化还原反应中,肯定有一种元素被氧化,另一种元素被还原 | |
| B. | 没有单质参加的反应一定不是氧化还原反应 | |
| C. | 置换反应一定是氧化还原反应 | |
| D. | 化合反应一定是氧化还原反应 |
分析 氧化还原反应的特征是元素化合价的升降,氧化还原反应可发生在不同元素之间,也可以是同种元素之间,结合相关物质的性质解答该题.
解答 解:A.氯气和水发生反应时,只有氯元素化合价发生变化,故A错误;
B.存在元素化合价的变化的反应是氧化还原反应,如二氧化硫与双氧水反应生成硫酸和水,没有单质参加,属于氧化还原反应,故B错误;
C.置换反应有单质参加和生成,元素化合价一定发生变化,一定属于氧化还原反应,故C正确;
D.存在元素化合价的变化的反应是氧化还原反应,氨气与HCl化合生成氯化铵,是化合反应,不是氧化还原反应,故D错误.
故选C.
点评 本题考查氧化还原反应,侧重于学生的分析能力和计算能力的考查,注意从元素化合价的角度认识氧化还原反应相关概念,答题时注意能举出实例,难度不大.


 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
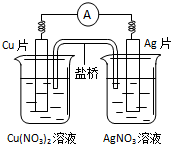
| A. | 电子沿导线由Cu片流向Ag片 | |
| B. | 正极的电极反应是Ag++e-=Ag | |
| C. | Cu片上发生氧化反应,Ag片上发生还原反应 | |
| D. | 反应时盐桥中的阳离子移向Cu(NO3)2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
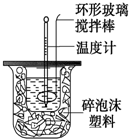 测定中和反应反应热的实验装置如图所示,实验结果产生偏差的原因不可能是( )
测定中和反应反应热的实验装置如图所示,实验结果产生偏差的原因不可能是( )| A. | 实验中使用的搅拌棒材料为铁 | |
| B. | 读取温度计读数时,读取的是混合溶液的最高温度 | |
| C. | 分多次把NaOH溶液倒入盛有硫酸的小烧杯中 | |
| D. | 用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5×10-6NA个DEHP分子 | |
| B. | 含有1.2×10-4NA个碳原子的DEHP分子 | |
| C. | 含有2×10-5NA个氧原子的DEHP分子 | |
| D. | 含有2.0×10-4NA个氢原子的DEHP分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 酸 | 电离方程式 | 电离平衡常数K |
| CH3COOH | CH3COOH?CH3COOH-+H+ | 1.76×10-5 |
| H2CO3 | H2CO3?H++HCO3-HCO3-?H++HCO32- | K1=4.31×10-7 K2=5.61×10-11 |
| H2S | H2S?H++HS-HS-?H++S2- | K1=9.1×10-8 K2=1.1×10-12 |
| H3PO4 | H3PO4?H++H2PO4-H2PO4-H++HPO42- HPO42-?H++PO43- | K1=7.52×10-3K2=6.23×10-8 K3=2.20×10-13 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com