
����Ŀ���й����ʵ�ת����ϵ��ͼ��ʾ��������������������ȥ����A���������ɫҺ�壬B��C�dz����Ľ������ʣ�D��E�����嵥�ʣ���D�ڿ����еĺ�����࣬F ��һ�־��д��ԵĻ����H�Ǽ�����ǿ�ᷴӦ������ǿ�Ӧ�������I�������¡�������������Ժõ��������ʣ��㷺Ӧ���ڵ��ӹ�ҵ���մɹ�ҵ�У� 
��ش��������⣺
��1��H�Ļ�ѧʽΪ ��
��2��D �ĵ���ʽΪ ��
��3��K����Ӧ�ٵĻ�ѧ����ʽ�� ��
��4��д��G��ˮ��Һ��C����������Һ��Ӧ�ķ���ʽ�� ��
���𰸡�
��1��Al2O3
��2��![]()
��3��3Fe+4H2O��g�� ![]() Fe3O4+4H2
Fe3O4+4H2
��4��Al3++3NH3?H2O=Al��OH��3��+3NH4+
���������⣺��1�������Ϸ�����֪HΪAl2O3���ʴ�Ϊ��Al2O3����2��DΪN2������ʽΪ ![]() ���ʴ�Ϊ��
���ʴ�Ϊ�� ![]() ����3������ˮ��Ӧ��������������������������ʽΪ3Fe+4H2O��g��
����3������ˮ��Ӧ��������������������������ʽΪ3Fe+4H2O��g�� ![]() Fe3O4+4H2���ʴ�Ϊ��3Fe+4H2O��g��
Fe3O4+4H2���ʴ�Ϊ��3Fe+4H2O��g�� ![]() Fe3O4+4H2����4����ˮ�ʼ��ԣ�����������Ӧ�����������������ӷ���ʽΪAl3++3NH3H2O=Al��OH��3��+3NH4+��
Fe3O4+4H2����4����ˮ�ʼ��ԣ�����������Ӧ�����������������ӷ���ʽΪAl3++3NH3H2O=Al��OH��3��+3NH4+��
�ʴ�Ϊ��Al3++3NH3H2O=Al��OH��3��+3NH4+��
A���������ɫҺ�壬ӦΪH2O��F ��һ�־��д��ԵĻ����ӦΪFe3O4����ת����ϵ��֪BΪFe��EΪH2��D�ڿ����еĺ�����࣬ӦΪN2����GΪNH3��F��C�ڸ����·�Ӧ����֪CΪAl��HΪAl2O3��I�������¡�������������Ժõ��������ʣ��㷺Ӧ���ڵ��ӹ�ҵ���մɹ�ҵ�У�ӦΪAlN���Դ˽����⣮


 ���źþ���Ԫ����ĩ��ϵ�д�
���źþ���Ԫ����ĩ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ��װ�ý���ʵ�飬�����к�����x��ʾ����缫�ĵ��ӵ����ʵ�����������������ȷ���ǣ� ��
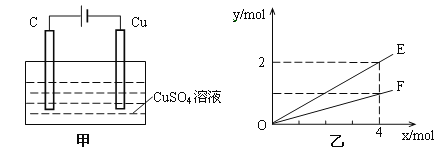
A. E��ʾ����ͭ�����ʵ���
B. E��ʾ��Ӧ����ˮ�����ʵ���
C. F��ʾ��Ӧ�������������ʵ���
D. F��ʾ������������ʵ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶�ʱ��AgCl��s��Ag+��aq��+Cl����aq����ˮ�еij����ܽ�ƽ��������ͼ��ʾ������˵����ȷ���ǣ������� 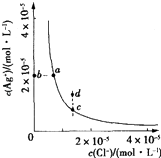
A.����AgNO3���壬����ʹ��Һ��c��䵽d��
B.����NaCl���壬��AgCl���ܽ�ȼ�С��KspҲ��С
C.d����AgCl��������
D.c���Ӧ��KspС��a���Ӧ��Ksp
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ĿǰΪֹ���ɻ�ѧ��ת������ܻ������Ȼ������ʹ�õ�����Ҫ����Դ��
��1����ѧ��Ӧ�зų������ܣ��ʱ䣬��H���뷴Ӧ���������ļ��ܣ�E���йأ� ��֪��H2��g��+Cl2��g���T2HCl��g����H=��185kJ/mol
E��H��H��=436kJ/mol��E��Cl��Cl��=243kJ/mol
��E��H��Cl��= ��
��2������Cu2O���ھ��������Ĵ����ܶ��ܵ���ע����֪�� 2Cu��s��+ ![]() O2��g���TCu2O��s����H=��169kJmol��1 ��
O2��g���TCu2O��s����H=��169kJmol��1 ��
C��s��+ ![]() O2��g���TCO��g����H=��110.5kJmol��1 ��
O2��g���TCO��g����H=��110.5kJmol��1 ��
2Cu��s��+O2��g���T2CuO��s����H=��314kJmol��1
��ҵ����̿���ڸ��������»�ԭCuO��ȡCu2O��CO���Ȼ�ѧ����ʽΪ ��
��3����ͼ��N2��H2��Ӧ����2mol NH3�����������仯ʾ��ͼ�������ÿ����1mol NH3�ų�����Ϊ �� 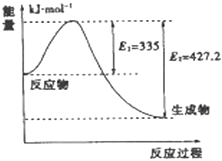
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2Zn(OH)2��ZnCO3���Ʊ�����ZnO���м��壬��п��ɰ����Ҫ�ɷ�ΪZnO��������Cu2+��Mn2+�����ӣ�Ϊԭ���Ʊ�2Zn(OH)2��ZnCO3�Ĺ����������£�
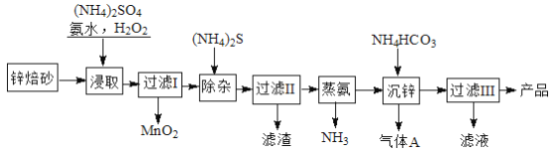
��ش��������⣺
��1����(NH4)2SO4��NH3��H2O�Ļ����Һ�д���c(NH4+)=2c(SO42-)ʱ����Һ��___________ (���������������������������ԡ�
��2������ȡ��ʱΪ�����п�Ľ����ʣ��ɲ�ȡ�Ĵ�ʩ��__________________����дһ������
��3������ȡ��ʱ�����NH3��H2O����������MnO2�����ӷ���ʽΪ____________________________��
��4������п�������ӷ���ʽΪ__________________________________��
��5��������III��������Һ��ѭ��ʹ�ã�����Ҫ�ɷֵĻ�ѧʽ��__________________��
��6����֪��HCN�ĵ��볣��Ka=4.9��10 -10�� H2S �ĵ��볣��Ka1=1.3��10 -7��Ka2=7.0��10 -15����NaCN ��Һ��ͨ��������H2S ���壬��Ӧ�����ӷ���ʽΪ______________________________________���ڷ�ˮ���������г���H2S ��Mn2+ת��ΪMnS ��ȥ������0.020 molL-1Mn2+��ˮ��ͨ��һ������H2S ���壬������Һ��pH=a����HS-Ũ��Ϊ1.0��10 -4molL-1ʱ��Mn2+��ʼ��������a=____________��[��֪�� Ksp(MnS)=1.4��10 -15]
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ�֪����ҵ���ǵϹ�˾�����˾��ж���ר����﮷���������ε�أ���ɱ��ϵͣ��Ի�������Ⱦ�������ܶ�ԶԶ�����������ϵ�أ�����ܷ�ӦΪ��V2O5+xLi![]() LixV2O5������˵������ȷ����
LixV2O5������˵������ȷ����
A����ڷŵ�ʱ���������ϣ����ʱΪ��������
B������ڷŵ�ʱ��Li+���ƶ�
C���õ�س��ʱ�����ķ�ӦΪ��LixV2O5 ��xe����V2O5 + xLi+
D��V2O5ֻ��﮷�����Ӧ�����壬�������ط�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й���������������ȷ����
A.��˿��������ȼ������FeCl2
B.���ȵ�ͭ˿�������о���ȼ�գ������ػ�ɫ����
C.������Һ�Ⱥ���ˮ���Ǵ��������Ư����
D.��������������ˮ����������ԭ��������������ɱ��ϸ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������õ�ʵ���� �� ��
A�������л���������� B�������л���ͷ�����
C���ֽ��л���������� D���ֽ��л���ͷ�����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com