
已知电离平衡常数:H2CO3>HClO>HCO3﹣,氧化性:HClO>Cl2>Br2>Fe3+>I2.下列有关离子反应或离子方程式的叙述中,正确的是( )
A.向0.1molFeI2溶液中滴加少量氯水,反应中有0.3NA电子转移
B.向溴水中加入足量氯化亚铁能使溶液变成无色
C.向NaClO溶液中通入少量CO2的离子方程式:2ClO﹣+CO2+H2O═2HClO+CO32﹣
D.能使pH试纸显深红色的溶液,Fe3+、Cl﹣、Ba2+、Br﹣能大量共存
科目:高中化学 来源:2017届江西省高三上第一次月考(开学考试)化学(解析版) 题型:实验题
(10分)用18mol·L-1,浓硫酸配制100mL 3.0mol·L-1稀硫酸的实验步骤如下:
①计算所用浓硫酸的体积 ②量取一定体积的浓硫酸 ③稀释、冷却
④转移、洗涤 ⑤定容、摇匀。
回答下列问题:
(1)所需浓硫酸的体积是_____mL,量取浓硫酸所用的量筒的规格是______(从下列规格中选用:
A.10mL | B.25mL | C.50mL | D.100mL )。 |
(2)配制上述溶液所需仪器,除量筒、烧杯和玻璃棒外,还必须用到的玻璃仪器有______、__________。
(3)第⑤步实验的操作是________________________。
(4)下列情况对所配制的稀硫酸浓度有何影响?(用“偏大”、“偏小”或“无影响”填写)
① 所用的浓硫酸长时间放置在密封不好的容器中_______________。
② 定容时俯视溶液的凹液面_______________________。
查看答案和解析>>
科目:高中化学 来源:2017届湖南省长沙市高三入学考试理综化学试卷(解析版) 题型:实验题
【化学-选修5:有机化学基础】 (15分)
用于治疗精神疾病的药物半富马酸喹硫平的一仲合成路线如下所示:
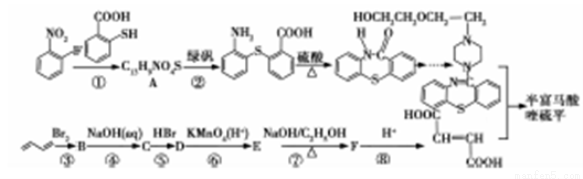
请回答下列问题:
(1)A中除硫醚键(-S-)外,还含有的官能团是______,反应③是l,3-丁二烯发生l,4-加成反应,则B的系统命名为___________。
(2)反应①~⑤中属于取代反应的有________(选填序号);流程中设计反应⑤和⑦的目的是___________________。
(3)写出反应⑦的化学方程式_____________。
(4)l,3-丁二烯分子中最多有_______个原子共平面,聚l,3-丁二烯的结构简式为__________。
(5)C的同分异构体有多种,符合下列条件的物质的结构简式为_________
① 能发生银镜反应;
② 能与NaoH溶液反应,与NaHCO3溶液不反应;
③ 核磁共振氢谱只有三组峰
查看答案和解析>>
科目:高中化学 来源:2017届湖南衡阳八中高三实验班暑期第一次月考理综化学(解析版) 题型:选择题
在100mLHNO3和H2SO4的混合溶液中,两种酸的物质的量浓度之和为0.6mol/L。向该溶液中加入足量的铜粉,加热,充分反应后,所得溶液中Cu2+的物质的量浓度最大值为(反应前后溶液体积变化忽略不计)
A.0.225mol/L B.0.30mol/L C.0.36mol/L D.0.45mol/L
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁省大连市高二下期末化学试卷(解析版) 题型:填空题
碘化亚铜(Cu2I2)是一种不溶于水也不溶于酸的白色固体,用途很广泛.完成下列填空:
(1)碘化钾溶液中滴加适量硫酸铜溶液,就能得到碘化亚铜.写出该反应的化学方程式 .
(2)往上述反应后溶液中加入淀粉,溶液变蓝,再滴加亚硫酸溶液,蓝色又褪去.写出KI、Cu2I2、H2SO3的还原性由强到弱的顺序是 .
(3)碘化亚铜能用于检测空气中的汞蒸气,其反应为:2Cu2I2+Hg═Cu2HgI4(玫瑰红)+2Cu,产物Cu2HgI4中Cu元素显 价.当有1molCu2I2参与反应时,转移电子 mol.
(4)为除去稀盐酸中少量CuCl2杂质,可往溶液中加入过量的M试剂后进行过滤操作,再通入适量的Cl2后进行N操作.试剂M和操作N的组合正确的是 (选填编号)
选项 | 试剂M | 操作N |
a | 碘化钾溶液 | 升华 |
b | 氢碘酸溶液 | 萃取分液 |
c | 氢气 | 过滤 |
d | 氢硫酸溶液 | 过滤 |
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁省大连市高二下期末化学试卷(解析版) 题型:选择题
选项 | 实验 | 现象 | 结论 |
A | SO2通入BaCl2溶液,然后滴入稀硝酸 | 产生白色沉淀,加入稀硝酸沉淀不溶解 | 开始的沉淀为BaSO3,后来转化为BaSO4 |
B | KBrO3溶液中加入少量苯,然后通入少量Cl2振荡 | 静止后有机相呈橙色 | 氧化性:Cl2>Br2 |
C | 向足量含淀粉的FeI2溶液中滴加2滴氯水 | 溶液变蓝 | 还原性:I﹣>Fe2+ |
D | 将重晶石浸泡在饱和碳酸钠溶液中 | 一段时间后固体溶解 | Ksp(BaCO3)<Ksp(BaSO4) |
A.A B.B C.C D.D
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁省大连市高二下期末化学试卷(解析版) 题型:选择题
元素周期表和元素周期律可以指导人们进行规律性的推测和判断.下列说法不合理的是( )
A. 若X+和Y2﹣的核外电子层结构相同,则原子序数:X>Y
B. 元素周期表中位于金属和非金属分界线附近能找到半导体的元素
C. Cs和Ba分别位于第六周期IA和IIA族,碱性:CsOH>Ba(OH)2
D. 由水溶液的酸性:HCl>H2S,可推断出元素的非金属性:Cl>S
查看答案和解析>>
科目:高中化学 来源:2017届河北沧州市高三上学期第一次月考化学试卷(解析版) 题型:选择题
截止到2013年12月末,中国光伏发电新增装机容量达到10.66GW,光伏发电累计装机容量达到17.16GW,图为光伏并网发电装置电解尿素[CO(NH2)2]的碱性溶液制氢的装置示意图(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极)。下列叙述中正确的是
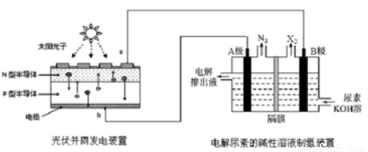
A.N型半导体为正极,P型半导体为负极
B.制氢装置溶液中电子流向:从B极流向A极
C.X2为氧气
D.工作时,A极的电极反应式为CO(NH2)2+8OH--6e-═CO32-+N2↑+6H2O
查看答案和解析>>
科目:高中化学 来源:2015-2016学年贵州省高二下学期期末化学卷(解析版) 题型:选择题
PH3是一种无色剧毒气体,其分子结构和NH3相似,但P?H键键能比N?H键键能低。下列判断错误的是( )
A. PH3分子呈三角锥形
B. PH3分子是极性分子
C. PH3沸点低于NH3沸点,因为P-H键键能低
D. PH3分子稳定性低于NH3分子,因为N-H键键能高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com