
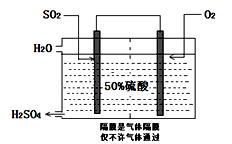
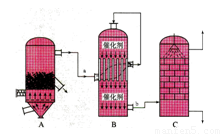
I.目前,我国采用“接触法”制硫酸,设备如图所示:

(1)图中设备A的名称是_____________,该设备中主要反应的化学方程式为 ??????????? 。
(2)有关接触法制硫酸的下列说法中,不正确的是_____(填字母序号)。
A.二氧化硫的接触氧化在接触室中发生
B.吸收塔用浓度为98.3%浓硫酸吸收三氧化硫
C.煅烧含硫48%的黄铁矿时,若FeS2损失了2%,则S损失2%
D.B装置中反应的条件之一为较高温度是为了提高SO2的转化率
E.硫酸工业中在接触室安装热交换器是为了利用SO3转化为 H2SO4时放出的热量
II.纯碱是一种重要的化工原料。制碱工业主要有“氨碱法”(索尔维法)和“联合制碱法”(侯氏制碱法)两种工艺。请按要求回答问题:
(3)CO2是制碱工业的重要原料,“联合制碱法”中CO2的来源于 ,“氨碱法”中CO2来源于 。
(4)氨碱法的原子利用率(原子利用率=期望产物的总质量与生成物的总质量之比) ??????? 。
(5)写出“联合制碱法”有关反应的化学方程式:?????????????????????????????? 。
Ⅰ.(1)沸腾炉?? 4FeS2 +11O2  2Fe2O3 + 8SO2 (2)D、E
2Fe2O3 + 8SO2 (2)D、E
Ⅱ.(3)合成氨厂?????? 煅烧石灰石??? (4)0.49 (106/217)
(5)NH3 + H2O + CO2 + NaCl(饱和)= NaHCO3 ↓+ NH4Cl
2NaHCO3 Na2CO3 + CO2 ↑+ H2O??
Na2CO3 + CO2 ↑+ H2O??
【解析】
试题分析:Ⅰ.(1) “接触法”制硫酸设备A的名称是沸腾炉;设备B的名称是接触室;设备C的名称是吸收塔。在设备A中主要反应的化学方程式为4FeS2 +11O2 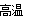 2Fe2O3 + 8SO2。(2)A.在接触室中发生反应:2SO2+O2
2Fe2O3 + 8SO2。(2)A.在接触室中发生反应:2SO2+O2  2SO3因此该选项正确。B.如果用水吸收SO3,容易形成酸雾,不利于SO3的吸收。所以在吸收塔中一般是用98.3%浓硫酸吸收三氧化硫形成发烟硫酸,然后再稀释成所需要的浓度。正确。C.C.煅烧含硫48%的黄铁矿时,若FeS2损失了2%,则其中各组分的损失也都是2%.这与物质的组成无关。正确。D.在设备B中发生的反应2SO2+O2
2SO3因此该选项正确。B.如果用水吸收SO3,容易形成酸雾,不利于SO3的吸收。所以在吸收塔中一般是用98.3%浓硫酸吸收三氧化硫形成发烟硫酸,然后再稀释成所需要的浓度。正确。C.C.煅烧含硫48%的黄铁矿时,若FeS2损失了2%,则其中各组分的损失也都是2%.这与物质的组成无关。正确。D.在设备B中发生的反应2SO2+O2  2SO3为放热反应,如果升高温度,根据平衡移动原理,升高温度,化学平衡会向吸热反应方向移动,对该反应来说就是向逆反应方向移动。这对于提高SO2的转化率不利。之所以采用较高的温度,是为了加快化学反应速率,缩短达到平衡所需要的时间。提高生产效率。错误。E.硫酸工业中在接触室安装热交换器是为了利用SO2氧化为SO3时的热量。错误。Ⅱ.(3)“联合制碱法”中CO2的来源于合成氨厂;“氨碱法”中CO2来源于煅烧石灰石。(4)氨碱法的化学反应原理为:NH3+CO2+H2O==NH4HCO3;NaCl+NH4HCO3==NaHCO3↓+NH4Cl? 2NaHCO3
2SO3为放热反应,如果升高温度,根据平衡移动原理,升高温度,化学平衡会向吸热反应方向移动,对该反应来说就是向逆反应方向移动。这对于提高SO2的转化率不利。之所以采用较高的温度,是为了加快化学反应速率,缩短达到平衡所需要的时间。提高生产效率。错误。E.硫酸工业中在接触室安装热交换器是为了利用SO2氧化为SO3时的热量。错误。Ⅱ.(3)“联合制碱法”中CO2的来源于合成氨厂;“氨碱法”中CO2来源于煅烧石灰石。(4)氨碱法的化学反应原理为:NH3+CO2+H2O==NH4HCO3;NaCl+NH4HCO3==NaHCO3↓+NH4Cl? 2NaHCO3  Na2CO3 + CO2 ↑+ H2O ;2NH4Cl+Ca(OH)2
Na2CO3 + CO2 ↑+ H2O ;2NH4Cl+Ca(OH)2  CaCl2+2NH3↑+2H2O。CO2、NH3循环利用。在该方法中,目标产物为Na2CO3;实际产物为Na2CO3和CaCl2。所以原子利用率为[106÷(106+111)]×100%=49% (或106/217)。(5) “联合制碱法”有关反应的化学方程式为NH3 + H2O + CO2 + NaCl(饱和)= NaHCO3 ↓+ NH4Cl; 2NaHCO3
CaCl2+2NH3↑+2H2O。CO2、NH3循环利用。在该方法中,目标产物为Na2CO3;实际产物为Na2CO3和CaCl2。所以原子利用率为[106÷(106+111)]×100%=49% (或106/217)。(5) “联合制碱法”有关反应的化学方程式为NH3 + H2O + CO2 + NaCl(饱和)= NaHCO3 ↓+ NH4Cl; 2NaHCO3  Na2CO3 + CO2 ↑+ H2O。
Na2CO3 + CO2 ↑+ H2O。
考点:考查“接触法”制硫酸、“联合制碱法”、 “氨碱法”的制取方法。包括设备的识别、反应方程式的书写、原料的来源、化学平衡移动、化学反应速率等知识。


科目:高中化学 来源: 题型:
I.目前,我国采用“接触法”制硫酸,设备如图所示:

(1)图中设备A的名称是_____________ 该设备中主要反应的化学方程式为 。
(2)有关接触法制硫酸的下列说法中,不正确的是______________。
A.二氧化硫的接触氧化在接触室中发生
B.吸收塔用浓度为98.3%浓硫酸吸收三氧化硫
C.煅烧含硫48%的黄铁矿时,若FeS2损失了2%,则S损失2%
D.B装置中反应的条件之一为较高温度是为了提高SO2的转化率
E.硫酸工业中在接触室安装热交换器是为了利用SO3转化为H2SO4时放出的热量
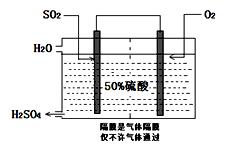
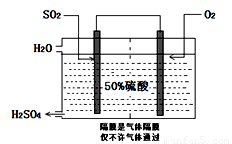
(3)科研工作者开发了制备SO2,再用电化学原理生产硫酸的方法,装置如图:为了稳定技术生产,硫酸的浓度应维持不变,则通入的SO2和水的质量比为 。
II. 纯碱是一种重要的化工原料。目前制碱工业主要有 “氨碱法”和“联合制碱法”两种工艺。请按要求回答问题:
(1)“氨碱法”产生大量CaCl2废弃物,请写出该工艺中产生CaCl2的化学方程式: ;
(2)写出“联合制碱法”有关反应的化学方程式: ;
。
(3)CO2是制碱工业的重要原料,“联合制碱法”中CO2的来源于 ,
“氨碱法”中CO2来源于 ;
查看答案和解析>>
科目:高中化学 来源: 题型:
I.目前,我国采用“接触法”制硫酸,设备如图所示:
(1)图中设备A的名称是_____________ 该设备中主要反应的化学方程式为 。
(2)有关接触法制硫酸的下列说法中,不正确的是______________。
A.二氧化硫的接触氧化在接触室中发生
B.吸收塔用浓度为98.3%浓硫酸吸收三氧化硫
C.煅烧含硫48%的黄铁矿时,若FeS2损失了2%,则S损失2%
D.B装置中反应的条件之一为较高温度是为了提高SO2的转化率
E.硫酸工业中在接触室安装热交换器是为了利用SO3转化为H2SO4时放出的热量
(3)科研工作者开发了制备SO2,再用电化学原理生产硫酸的方法,装置如图:为了稳定技术生产,硫酸的浓度应维持不变,则通入的SO2和水的质量比为 。
II. 纯碱是一种重要的化工原料。目前制碱工业主要有 “氨碱法”和“联合制碱法”两种工艺。请按要求回答问题:
(1)“氨碱法”产生大量CaCl2废弃物,请写出该工艺中产生CaCl2的化学方程式: ;
(2)写出“联合制碱法”有关反应的化学方程式: ;
。
(3)CO2是制碱工业的重要原料,“联合制碱法”中CO2的来源于 ,
“氨碱法”中CO2来源于 ;
查看答案和解析>>
科目:高中化学 来源:2011届吉林省普通中学高三下学期期中教学质量检测理综化学部分 题型:填空题
I.目前,我国采用“接触法”制硫酸,设备如图所示:
(1)图中设备A的名称是_____________ 该设备中主要反应的化学方程式为 。
(2)有关接触法制硫酸的下列说法中,不正确的是______________。
A.二氧化硫的接触氧化在接触室中发生 | B.吸收塔用浓度为98.3%浓硫酸吸收三氧化硫 |
| C.煅烧含硫48%的黄铁矿时,若FeS2损失了2%,则S损失2% | |
| D.B装置中反应的条件之一为较高温度是为了提高SO2的转化率 |
 氨碱法”中CO2来源于 ;
氨碱法”中CO2来源于 ;查看答案和解析>>
科目:高中化学 来源:2010-2011学年吉林省高三下学期期中教学质量检测理综化学部分 题型:填空题
I.目前,我国采用“接触法”制硫酸,设备如图所示:
(1)图中设备A的名称是_____________ 该设备中主要反应的化学方程式为 。
(2)有关接触法制硫酸的下列说法中,不正确的是______________。
A.二氧化硫的接触氧化在接触室中发生
B.吸收塔用浓度为98.3%浓硫酸吸收三氧化硫
C.煅烧含硫48%的黄铁矿时,若FeS2损失了2%,则S损失2%
D.B装置中反应的条件之一为较高温度是为了提高SO2的转化率
E.硫酸工业中在接触室安装热交换器是为了利用SO3转化为H2SO4时放出的热量
(3)科研工作者开发了制备SO2,再用电化学原理生产硫酸的方法,装置如图:为了稳定技术生产,硫酸的浓度应维持不变,则通入的SO2和水的质量比为 。
II. 纯碱是一种重要的化工原料。目前制碱工业主要有 “氨碱法”和“联合制碱法”两种工艺。请按要求回答问题:
(1)“氨碱法”产生大量CaCl2废弃物,请写出该工艺中产生CaCl2的化学方程式: ;
(2)写出“联合制碱法”有关反应的化学方程式: ;
。
(3)CO2是制碱工业的重要原料,“联合制碱法”中CO2的来源于 ,
“氨碱法”中CO2来源于 ;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com