
【题目】二氧化氯是一种广谱杀菌消毒剂,有众多的用途,工业上制取二氧化氯的化学方程式如下:2NaClO3+ 2NaCl+2H2SO4![]() 2ClO2↑+Cl2↑+2H2O+2Na2SO4。
2ClO2↑+Cl2↑+2H2O+2Na2SO4。
(1)完成下列计算:0.2 mol NaClO3完全反应,得到气体的体积为__________L(标准状况)。
(2)将27.0 g ClO2溶于水得0.5 L溶液,则ClO2的物质的量浓度为__________mol/L。
(3)为使上述反应产生的Cl2转化为ClO2,将得到的混合气体和NaClO2反应,反应方程式为:2NaClO2 + Cl2![]() 2ClO2+2NaCl。假设NaClO3的转化率为90%,Cl2的转化率为95%,计算由0.2 mol NaClO3最终可制得的ClO2的质量(保留两位小数)_____。
2ClO2+2NaCl。假设NaClO3的转化率为90%,Cl2的转化率为95%,计算由0.2 mol NaClO3最终可制得的ClO2的质量(保留两位小数)_____。
【答案】 6.72 0.8 23.70 g
【解析】
试题(1)从反应分析2摩尔铝酸钠反应生成1摩尔氯气,所以当0.2摩尔铝酸钠反应生成0.1摩尔氯气和0.2摩尔二氧化氯,总共0.3摩尔气体,标况下的体积为0.3×22.4=6.72L。
(2)27.0克二氧化氯的物质的量为27.0/67.5=0.4摩尔,其物质的量浓度为0.4/0.5=0.8mol/L。(3)根据方程式找出关系式为:2NaClO3~~ 2ClO2↑~~~ Cl2↑~2NaClO2~~~~2 ClO2,0.2摩尔铝酸钠反应转化率为90%,生成二氧化氯的物质的量为0.2×90%=0.18摩尔,生成的氯气为0.09摩尔,则氯气再与NaClO2反应生成二氧化氯,转化率为95%,则生成的二氧化氯为0.09×2×95%=0.171摩尔,则二氧化氯的物质的量总共为0.18+0.171=0.351摩尔,其质量为0.351×67.5=23.70克。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列各组物质中,固定容器中,无论以何比例混合,其密度都不变的是
A. CH4 和 C2H4 B. C3H6和 CO2
C. C2H6和 C2H4 D. CO和C2H4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组同学为了探究“在相同的温度和压强下、相同体积的任何气体都含有相同数目和分子”,他们设计了如下实验装置并记录相关实验数据。实验装置:
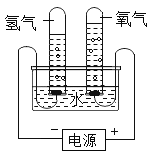
部分实验数据:
温度 | 压强 | 时间 | 水槽中H2O的质量 | H2体积 | O2体积 |
30℃ | 101 kPa | 0 | 300 g | 0 | 0 |
30℃ | 101 kPa | 4分钟 | 298.2 g | 1.243 L |
请回答下列问题:
(1)4分钟时H2、O2物质的量分别是__________mol、___________mol。
(2)该温度下,气体摩尔体积是________________。
(3)假设电解H2O速率相同,2分钟时试管内收集到的H2的体积是___________mL。
(4)根据以上实验得出如下结论,其中不正确的是_________________。
A. 气体摩尔体积与气体的温度相关
B. 在该实验条件下,3 mol O2的气体摩尔体积为74.58 L/mol
C. 同温、同压下,2 mol O2和2 mol CO和CO2混合气体的体积相同
D. 该实验条件下,O2的密度为1.287 g/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大气中可吸入颗粒物PM2.5主要来源为燃煤、机动车尾气等。
(1)若取某PM2.5样本,用蒸馏水处理,测得溶液中含有的离子有:K+、Na+、NH4+、SO42-、NO3-、Cl-,该溶液呈酸性,其原因用离子方程式解释是:____________。
(2)“洗涤”燃煤烟气可减轻PM2.5中SO2的危害,下列可适用于吸收SO2的试剂有(____)
a.CaCl2溶液 b.氨水 c.Ca(OH)2悬浊液 d.浓H2SO4
(3)煤烟气中的氮氧化物可用CH4催化还原成无害物质。若常温下,1molNO2与CH4反应,放出477.5kJ热量,该反应的热化学方程式是 __________ 。
(4)安装汽车尾气催化转化器也可减轻PM2.5的危害,其反应是:2NO(g) + 2CO(g)![]() 2CO2(g) + N2(g);△H<0。该反应平衡常数表达式K= ________;温度升高K值______(填“增大”或“减小” )
2CO2(g) + N2(g);△H<0。该反应平衡常数表达式K= ________;温度升高K值______(填“增大”或“减小” )
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A是来自石油的重要有机化工原料,其产量用来衡量一个国家石油化工发展水平,E是具有果香味的有机物,F是一种高聚物,可制成多种包装材料。

(1) A的名称为____;C分子中的官能团名称为_________。
(2)反应③的化学方程式为_________;该反应的反应类型为_________。
(3)反应④的化学方程式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】维尔纳配合物M是一种橙黄色单斜晶体,该晶体以浓氨水、双氧水、CoCl2·6H2O、NH4Cl为原料在加热条件下通过活性炭的催化来合成。为探究该晶体的组成,设计了如下实验:
步骤一,氮的测定:准确称取一定量橙黄色晶体,加入适量水溶解,注入下图所示的三颈瓶中,然后逐滴加入足量10%NaOH溶液,通入水蒸气,将样品中的氨全部蒸出,用500.00mL7.0mol/L的盐酸溶液吸收,吸收结束后量取吸收液25.00mL,用2.00mol/L的NaOH溶液滴定过量的盐酸,终点消耗NaOH溶液12.50mL。
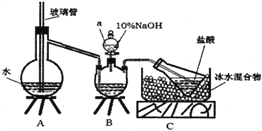
步骤二,氯的测定:准确称取橙黄色晶体wg,配成溶液后用AgNO3标准溶液滴定,以K2CrO4溶液为指示剂,至出现淡红色沉淀不再消失为终点(Ag2CrO4为砖红色沉淀)。
(1)上述装置A中,玻璃管的作用是________;装置B中仪器a的名称为_________。
(2)装置A、B三脚架处应放置一个酒精灯作为热源,酒精灯应放置在____(填“A”或“B”)处。
(3)步骤一所称取的样品中含氮的质量为_________g。
(4)有同学提出装置C中所用盐酸的浓度过大易挥发,会造成测得氮的含量结果将_______(填“偏高”、“偏低”或“无影响”);冰水混合物的作用是___________。
(5)测定氯的过程中,使用棕色滴定管的原因是_________;出现浅红色沉淀时,若溶液中c(CrO42-)=0.0025mol/L,通过计算说明该实验可以使用K2CrO4溶液为指示剂的原因______(呈现计算过程)。已知:Ksp(Ag2CrO4)=1.0×10-12Ksp(AgCl)=1.8×10-10
(6)经上述实验测定,配合物M中钴、氮、氯的物质的量之比为1:6:3,其中氮元素以氨的形式存在。制备M的化学方程式为_____________________,其中双氧水的作用是__________;制备M的过程中温度不能过高的原因是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于漂白粉的叙述正确的是( )
A.漂白粉的有效成分是Ca(ClO)2和CaCl2
B.漂白粉在空气中久置后会变质失效
C.漂白粉的有效成分Ca(ClO)2不稳定,易分解
D.在使用漂白粉时要加盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠(NaNO2)是一种生活中常用的食品添加剂,但使用时必须严格控制其用量。某兴趣小组将下图装置连接起来制备NaNO2(装置可重复使用,A中加热装置已略去)。

兴趣小组查阅资料可知:
①2NO+Na2O2=2NaNO2;
②NO能被酸性KMnO4氧化成NO3-,MnO4-被还原为Mn2+;
③在酸性条件下NaNO2能把I-氧化为I2,NO2-被还原为NO;Na2S2O3与I2的反应为2Na2S2O3+I2=Na2S4O6+2NaI
(1)连接装置的顺序为________。
(2)装置A三颈烧瓶中发生反应的化学方程式为______________;为保证制得的亚硝酸纯度,装置B中盛放的试剂可能是_________(填序号)。
A.P2O5 B.碱石灰 C.无水CaCl2 D.生石灰
(3)C装置的目的是_____________;E装置的作用是_____________。
(4)利用NaNO2的氧化性来测定其纯度的步骤是:准确称取mgNaNO2样品放人锥形瓶中,加适量水溶解,再加过量clmol·L-lKI溶液VlmL和几滴淀粉溶液,然后滴加稀硫酸,用c2mol·L-1Na2S2O3溶液滴定消耗V2mL。
①滴定终点的判断方法是____________;②NaNO2的质量分数__________%(写出表达式即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com