
下列关于化学平衡常数的说法中,正确的是
A.化学平衡常数均无单位
B.平衡常数越大则转化率越大
C.对于一个化学计量数固定的反应,平衡常数的大小只与温度有关
D.在平衡常数表达式中,反应物的浓度为初始浓度,生成物的浓度为平衡浓度
科目:高中化学 来源:2014-2015学年河南鄢陵县第一高中高一上第一次考试化学(A)试卷(解析版) 题型:选择题
下列转化中,只有加入氧化剂才能完成的是( )
A.H+―→H2 B.MnO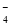 ―→Mn2+ C.CO2―→CO
―→Mn2+ C.CO2―→CO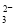 D.S2-―→SO
D.S2-―→SO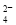
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省高一上第二次考试化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数,下列说法中正确的是( )。
A.1NA个氢气分子所占的体积为22.4 L
B.2NA个二氧化碳分子的质量为88 g
C.0.1 mol/L 的NaCl溶液中,Na+与Cl-离子总数为0.2NA
D.17 g NH3中所含原子数为NA
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省高二上学期期中化学试卷(解析版) 题型:选择题
某原电池装置如图所示,电池总反应为2Ag+Cl2===2AgCl。下列说法正确的是
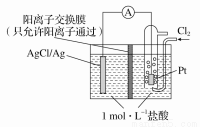
A.当电路中转移0.1 mol e-时,交换膜左侧溶液中约减少0.2 mol离子
B.放电时,交换膜两侧溶液中均有大量白色沉淀生成
C.若用NaCl溶液代替盐酸,则电池总反应随之改变
D.正极反应为AgCl+e-===Ag+Cl-
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省高二上学期期中化学试卷(解析版) 题型:选择题
在一定温度下,反应AB(g) 
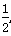 A2(g)+
A2(g)+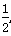 B2(g)的平衡常数为0.1 。若将1.0 mol的AB(g)通入体积为1.0 L的密闭容器中,在该温度时AB(g)的最大分解率接近于
B2(g)的平衡常数为0.1 。若将1.0 mol的AB(g)通入体积为1.0 L的密闭容器中,在该温度时AB(g)的最大分解率接近于
A.5% B.17% C.25% D.33%
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省高一上学期期中化学试卷(解析版) 题型:实验题
(12分)(实验题)下图为配制250 mL 0.2 mol/L Na2CO3溶液的示意图。

回答下列问题:
(1)①中称得Na2CO3________g;选取容量瓶规格:______________
(2)容量瓶使用前检验漏水的方法是 ____________________。
(3)若出现如下情况,对所配溶液浓度有何影响?(填“偏高”“偏低”或“无影响”)
A.某同学在第⑧步观察液面时俯视________;
B.没有进行操作步骤④和⑤________;
C.在第⑤步不慎有少量液体流到容量瓶外 ________。
D.未经冷却趁热将溶液注入容量瓶中定容 ________。
E.摇匀后发现液面低于刻度线再加水 _______
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省高一上学期期中化学试卷(解析版) 题型:选择题
下列各组中的离子,能在溶液中大量共存的是
A.Na+、H+、SO42-、OH-
B.K+、Ca2+、CO32-、NO3-
C.Na+、H+、Cl-、CO32-
D.K+、Cu2+、Cl-、SO42-
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省洛阳市高二10月月考化学试卷(解析版) 题型:填空题
(1)工业制氢气的一个重要反应是:CO(g)+ H2O(g) == CO2(g) + H2(g)
已知25℃时:C(石墨) +O2 (g) == CO2(g) △H1 =-394 kJ·mol-1
C(石墨) +1/2O2 (g) == CO (g) △H2 =-111 kJ·mol-1
H2(g) +1/2O2 (g)== H2O(g) △H3=-242kJ·mol-1
试计算25℃时CO(g)+ H2O(g) == CO2(g) + H2(g)的反应热______kJ·mol-1
(2)830K时,在密闭容器中发生下列可逆反应:
CO(g)+H2O(g)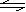 CO2(g)+H2(g);△H<0 试回答下列问题:
CO2(g)+H2(g);△H<0 试回答下列问题:
①若起始时c(CO)=2 mol·L-1,c(H2O)=3 mol·L-1,达到平衡时CO的转化率为60%,则在该温度下,该反应的平衡常数K= .
②在相同温度下,若起始时c(CO)=1 mol·L-1,c(H2O)=2 mol·L-1,反应进行一段时间后,测得H2的浓度为0.5 mol·L-1,则此时该反应是否达到平衡状态 (填“是”与“否”),此时v(正) v(逆)(填“大于”“小于”或“等于”),你判断的依据是
③若降低温度,该反应的K值将 ,该反应的化学反应速率将 (均填“增大”“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省汝州市高二上学期第一次月考化学试卷(解析版) 题型:填空题
已知NO2和N2O4可以相互转化:N2O4(g) 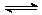 2NO2(g) △H<0,现将一定量NO2和N2O4的混合气体,通入体积为1L的恒温密闭容器中,各物质浓度随时间变化关系如下图所示:
2NO2(g) △H<0,现将一定量NO2和N2O4的混合气体,通入体积为1L的恒温密闭容器中,各物质浓度随时间变化关系如下图所示:

(1)图中共有两条曲线X和Y,其中表示N2O4浓度 随时间变化的曲线是_________
(2)前10min内,v(N2O4)= ______________ ;
(3)a、b、c、d四个点中,表示化学反应处于平衡状态的是____,此时反应的平衡常数为______________(只要求写数值)
(4)反应进行到25min时,曲线发生变化的原因是____________________________;
若要达到最后相同的化学平衡状态,在25min时还可以采取的措施是( )(双选)
A.升高温度 B.缩小容器体积 C.加入催化剂 D.加入一定量的N2O4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com