
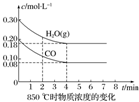
 已知:CO(g)+H2O(g)?CO2(g)+H2(g)△H=Q,其平衡常数随温度变化如下表所示:
已知:CO(g)+H2O(g)?CO2(g)+H2(g)△H=Q,其平衡常数随温度变化如下表所示:| 温度/℃ | 400 | 500 | 850 |
| 平衡常数 | 9.94 | 9 | 1 |
分析 (1)化学平衡常数是指:一定温度下,可逆反应到达平衡时,生成物的浓度系数次幂之积与反应物的浓度系数次幂之积的比,固体、纯液体不需要在化学平衡常数中写出;
由表中数据可知,温度越高平衡常数越小,说明升高温度平衡逆向应移动,升高温度平衡向吸热方向移动;
(2)根据v=$\frac{△c}{△t}$计算0~4min时平均反应速率v(CO);
(3)到达平衡时CO的 转化率最大,令平衡时CO的浓度变化量为cmol/L,表示出平衡时各组分的浓度,再利用平衡常数列方程计算解答;
(4)起始时水的物质的量为xmol,转化的CO的物质的量为 (1-x)ymol,平衡时CO的转化率为y,则转化的CO为(1-x)y mol,利用三段式法求出平衡时各组分的物质的量,代入800℃平衡常数计算解答.
解答 解:(1)CO(g)+H2O(g)?CO2(g)+H2(g)的平衡常数为K=$\frac{c(C{O}_{2})×c({H}_{2})}{c(CO)×c({H}_{2}O)}$;
由表中数据可知,温度越高,平衡常数越小,说明升高温度平衡逆向应移动,升高温度平衡向吸热方向移动,故正反应为放热反应,则△H=Q<0,
故答案为:$\frac{c(C{O}_{2})×c({H}_{2})}{c(CO)×c({H}_{2}O)}$;<;
(2)v(CO)=$\frac{0.2mol/L-0.08mol/L}{4min}$=0.03mol/(L•min),
故答案为:0.03mol/(L•min);
(3)到达平衡时CO的 转化率最大,设CO的浓度变化量为c,则:
CO(g)+H2O(g)?H2(g)+CO2(g)
起始(mol/L):0.02 0.02 0 0
转化(mol/L):c c c c
平衡(mol/L):0.02-c 0.02-c c c
500℃时反应平衡常数K=$\frac{c×c}{(0.02-c)×(0.02-c)}$=9,解得c=0.015,
CO的最大所以转化率为:$\frac{0.015mol/L}{0.2mol/L}$×100%=75%,
故答案为:75%;
(4)800℃时反应平衡常数为1,起始时水的物质的量为xmol,CO的物质的量为 (1-x)mol,平衡时CO的转化率为y,则转化的CO为(1-x)y mol,则:
CO(g)+H2O(g)?H2(g)+CO2(g)
起始(mol):1-x x 0 0
转化(mol):(1-x)y (1-x)y (1-x)y (1-x)y
平衡(mol):(1-x)(1-y) (x-y+xy)(1-x)y (1-x)y
所以平衡常数K=$\frac{(1-x)y×(1-x)y}{(1-x)(1-y)×(x-y+xy)}$=1,整理得x=y,
故答案为:x=y.
点评 本题考查化学平衡计算、平衡常数、反应速率计算等,掌握三段式在化学平衡计算中应用,掌握化学平衡常数的用途:1、判断反应进行的程度,2、判断反应的热效应,3、判断反应进行的方向,4、计算转化率等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol/L的NaHA溶液pH=5,则溶液:c(HA-)>c(H+)>c(A2-)>c(H2A) | |
| B. | 等体积、等物质的量浓度的NaCl(aq) 微粒种类大于NaClO(aq)中微粒种类 | |
| C. | pH=3的硫酸溶液中水的电离程度大于pH=11的氨水溶液中水的电离程度 | |
| D. | 体积相同的0.1 mol/L氨水和0.1 mol/L NaOH溶液中和盐酸的能力后者大 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制Fe(NO3)2溶液时,为了防止Fe2+水解可向溶液中加入适量的稀硝酸 | |
| B. | 向饱和Na2CO3溶液中加少量BaSO4粉末,过滤,向洗净的沉淀中加稀盐酸,有气泡产生,则Ksp(BaCO3)<Ksp(BaSO4) | |
| C. | pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1 | |
| D. | 已知I2可溶于KI形成KI3,向两支盛有KI3溶液的试管中,分别滴加淀粉溶液和AgNO3溶液,前者溶液变蓝,后者有黄色沉淀,说明KI3溶液中存在平衡:I3-?I2+I- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+MnO4- Cl- SO42- | B. | Na+K+NH4+Ba2+ | ||
| C. | Na+HCO3- NO3- SO42- | D. | Na+SO42- S2- Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某无色溶液中加入AgNO3溶液得白色沉淀,加稀硝酸沉淀不消失,则原溶液一定存在Cl-或CO32- | |
| B. | 某无色溶液中滴加BaCl2溶液得白色沉淀,加稀硝酸沉淀不溶解,则一定含有SO42- | |
| C. | 做水的蒸馏实验时,要在烧瓶内加几粒沸石以防止暴沸 | |
| D. | 某无色溶液中滴加CaCl2溶液得白色沉淀,若加入盐酸则生成无色气体,该气体能使澄清石灰水变浑浊,则原溶液中一定有CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 做金属钠与水反应实验时,剩余的钠不能再放入原试剂瓶 | |
| B. | 配制480mLNaOH溶液需要的主要仪器有480mL容量瓶、玻璃棒、烧杯、量筒等 | |
| C. | 将固体药品放在蒸发皿中进行高温焙烧 | |
| D. | 冷凝管中冷却水的流向一定是下口进水、上口出水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com