
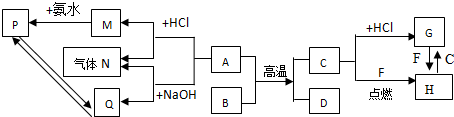
分析 A是地壳中含量最高的金属元素,则A为Al,B是一种红棕色固体,二者反应得到C与D,且C是C 为日常生活中常见的金属单质,则B为Fe2O3,单质金属C为Fe,D为Al2O3,Fe与盐酸反应得到G,G与F反应得到H,且Fe与F反应也得到H,H能与Fe反应得到G,则F为Cl2、G为FeCl2、H为FeCl3,结合转化关系可知,N为H2,M为AlCl3,P为Al(OH)3,Q为NaAlO2,据此解答.
解答 解:A是地壳中含量最高的金属元素,则A为Al,B是一种红棕色固体,二者反应得到C与D,且C是C 为日常生活中常见的金属单质,则B为Fe2O3,单质金属C为Fe,D为Al2O3,Fe与盐酸反应得到G,G与F反应得到H,且Fe与F反应也得到H,H能与Fe反应得到G,则F为Cl2、G为FeCl2、H为FeCl3,结合转化关系可知,N为H2,M为AlCl3,P为Al(OH)3,Q为NaAlO2.
(1)由上述分析可知,D为Al2O3,Q为NaAlO2,故答案为:Al2O3;NaAlO2;
(2)检验FeCl3中阳离子的方法是:取FeCl3溶液少许于试管中,滴加几滴KSCN溶液,若溶液呈红色,则存在Fe3+,
故答案为:取FeCl3溶液少许于试管中,滴加几滴KSCN溶液,若溶液呈红色,则存在Fe3+;
(3)向FeCl2中加入氢氧化钠溶液,露置于空气中的现象为:有白色絮状沉淀生成,沉淀迅速变为灰绿色,最终变为红褐色,
故答案为:有白色絮状沉淀生成,沉淀迅速变为灰绿色,最终变为红褐色;
(4)Fe与水蒸气在高温条件反应的化学方程式:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2,
故答案为:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2;
(5)氢氧化铝转化为偏铝酸钠的离子方程式:Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Al(OH)3+OH-=AlO2-+2H2O.
点评 本题考查无机物推断,涉及Al、Fe等元素化合物性质,物质颜色及特殊的反应是推断的关键,注意对基础知识的理解掌握.


 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 烧杯中固体有铁、无铜 | B. | 烧杯中固体有铜、无铁 | ||
| C. | 烧杯中固体铁、铜都有 | D. | 烧杯中固体铁、铜都无 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上常以海带或其它海产品为原料提取碘 | |
| B. | 炼铁和制玻璃的工业中都要用到石灰石 | |
| C. | 氯气通入石灰乳中制漂白粉 | |
| D. | 电解氯化钠溶液制金属钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| T/℃ | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com