
【题目】钒(V)及其化合物广泛应用于工业催化、新材料和新能源等领域。
(1)V2O5是接触法制硫酸的催化剂。
①已知25℃,10lkPa时:
2SO2(g)+O2(g)+2H2O(1)=2H2SO4(1) △H = -457kJ·mol-l
SO3(g)+H2O(1)=H2SO4(1) △H= -130kJ·mol-l
则反应2SO2(g)+O2(g)![]() 2SO3(g)的△H=_______kJ·mol-l。使用V2O5作催化剂后该反应逆反应的活化能______(填“增大”、“不变”或“减小”)。
2SO3(g)的△H=_______kJ·mol-l。使用V2O5作催化剂后该反应逆反应的活化能______(填“增大”、“不变”或“减小”)。
②SO2水溶液可与SeO2反应得到硫酸,当有79gSe生成时,转移电子的物质的量为______mol,此反应的化学方程式是___________________________。
(2)全钒液流电池的结构如图所示,其电解液中含有钒的不同价态的离子、H+和SO42-。电池放电时,负极的电极反应为:V2+-e一=V3+。
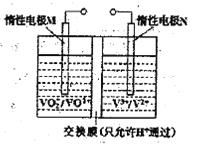
①电池放电时的总反应方程式为____________。充电时,电极M应接电源的____________极。
②若电池初始时左、右两槽内均以VOSO4和H2SO4的混合液为电解液,使用前需先充电激活,充电过程阴极区的反应分两步完成:第一步VO2+转化为V3+;第二步V3+转化为V2+。则第一步反应过程中阴极区溶液n(H+)______(填“增大”、“不变”或“减小”),阳极的电极反应式为:_______________。
【答案】-197 减小 4 2SO2+SeO2+2H2O=2H2SO4+Se VO2++V2++2H+=VO2++V3++H2O 正极 减小 VO2++H2O-e= VO2++2H+
【解析】
(1)①根据盖斯定律求△H。催化剂能降低正、逆反应的活化能,同等程度地加快正逆反应速率。
②SO2水溶液可与SeO2反应得到硫酸,SeO2转化为Se,根据Se的化合价变化和Se的质量可得转移电子的物质的量,根据电子守恒和质量守恒写出此反应的化学方程式。
(2)①根据电池放电时,负极的电极反应为:V2+-e一=V3+可知正极是VO2+转化为VO2+,可写出电池放电时的总反应方程式。充电时,原电池的负极接直流电源的负极,原电池的正极接直流电源的正极。
②第一步VO2+转化为V3+,写出电极反应式判断溶液n(H+)的变化,阳极是VO2+失电子生成VO2+。
(1)①已知:2SO2(g)+O2(g)+2H2O(1)=2H2SO4(1) △H = -457kJ·mol-l
SO3(g)+H2O(1)=H2SO4(1) △H= -130kJ·mol-l,根据盖斯定律,2SO2(g)+O2(g)![]() 2SO3(g)的△H= -457kJ·mol-l—2×(-130kJ·mol-l)= -197 kJ·mol-l;使用催化剂,降低活化能,使反应速率加快。
2SO3(g)的△H= -457kJ·mol-l—2×(-130kJ·mol-l)= -197 kJ·mol-l;使用催化剂,降低活化能,使反应速率加快。
②Se元素由+4价降低为0,所以当有79gSe生成时,转移转移电子的物质的量为:79g÷79g/mol×4=4mol;根据氧化还原反应规律,SO2、SeO2、H2O反应生成H2SO4和Se,配平可得化学方程式:2SO2+SeO2+2H2O=2H2SO4+Se
(2)①根据电池结构图,放电时负极V2+-e一=V3+,则正极上VO2+得电子生成VO2+,所以放电时的总反应方程式为:VO2++V2++2H+=VO2++V3++H2O;电极M为电池的正极,充电时应接电源的正极。
②第一步VO2+转化为V3+的电极反应式为:VO2++4H++2e= V3++2H2O,消耗了H+,所以阴极区溶液n(H+)减小;阳极上VO2+失电子生成VO2+,所以电极方程式为:VO2++ H2O-e= VO2++2H+。


科目:高中化学 来源: 题型:
【题目】某化学课外小组用右图装置制取溴苯并探究该反应的类型。先向分液漏斗中加入苯和液溴,再将混合液滴入反应器A(A下端活塞关闭)中。
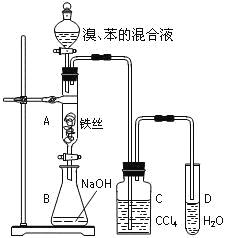
(1)写出A中反应的化学方程式:________________________________________。
(2)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是_________________________。
(3)C中盛放CCl4的作用是_____________________________。
(4)若要证明苯和液溴发生的是取代反应,而不是加成反应,通常有两种方法,请按要求填写下表。
向试管D中加入的试剂 | 能证明苯与液溴发生取代反应的现象 | |
方法一 | _____________ | _________________ |
方法二 | _____________ | _________________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:H2的标准燃烧热为-286 kJ · mol-1,CO的标准燃烧热为-283 kJ · mol-1,液态甲醇(CH3OH)标准燃烧热为-726 kJ · mol-1。由H2(g)与CO2(g)合成CH3OH(l)的ΔH为:
A. +297 kJ · mol-1 B. +151 kJ · mol-1
C. -132 kJ · mol-1 D. -1548 kJ · mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,将3 mol A和1 mol B两种气体混合于固定容积为2 L的密闭容器中,发生如下反应:3A(g)+B(g) ![]() xC(g)+2D(g)。2 min末该反应达到平衡,生成0.8 mol D,并测得C的浓度为0.8 mol·L-1。下列判断错误的是( )
xC(g)+2D(g)。2 min末该反应达到平衡,生成0.8 mol D,并测得C的浓度为0.8 mol·L-1。下列判断错误的是( )
A. x=4 B. 2 min内B的反应速率为0.1 mol·(L·min)-1
C. 混合气体密度不变,则表明该反应已达到平衡状态 D. B的转化率为40%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验能达到实验目的的是
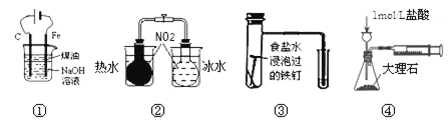
A.用图①装置制备Fe(OH)2并能较长时间观察其颜色
B.用图②装置探究温度对平衡移动的影响
C.用图③装置验证铁发生析氢腐蚀
D.用图④装置测定反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制乙酸乙酯的主要装置如图所示:
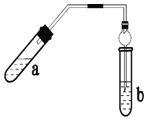
主要步骤:
①在 a 试管中 按 2:3:2 的体积比配制浓硫酸、乙醇、乙酸的混合物;
②按 A 图连接装置,使产生的蒸气经导管通到 b 试管所盛的饱和碳酸钠溶液中;
③小火加热 a 试管中 的混合液;
④等 b 试管中收集到约 2mL 产物时停止加热。撤下 b 试管并用力振 荡,然后静置待其中液体分层;
⑤分离出纯净的乙酸乙酯。
请回答下列问题:
⑴实验室配制混合物加入试剂顺序:______。
⑵步骤![]() 中可观察到 b 试管中有细小的气泡冒出,写出该反应的离子方程式:______。
中可观察到 b 试管中有细小的气泡冒出,写出该反应的离子方程式:______。
⑶A 装置中使用球形干燥管除起到冷凝作用外,另一重要作用是______,步骤![]() 中分离乙 酸乙酯必须使用的一种仪器是______。
中分离乙 酸乙酯必须使用的一种仪器是______。
⑷为证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用图 A 所示装置进行了以下 4 个实验。实验开始先用酒精灯微热 3min,再加热使之微微沸腾 3min。实验结束后充分振荡小试管 b 再测 有机层的厚度,实验记录如下:
实验编号 | 试管 a 中试剂 | 试管 b 中试剂 | 测得有机层的厚度/cm |
W | 3mL 乙醇、2mL 乙酸、2mL 18mol/L 浓硫酸 | 饱和 Na2CO3 溶液 | 5.0 |
X | 3mL 乙醇、2mL 乙酸 | 0.1 | |
Y | 3mL 乙醇、2mL 乙酸、2mL3mol/LH2SO4 | 1.2 | |
Z | 3mL 乙醇、2mL 乙酸、盐酸 | 1.2 |
①实验 Y 的目的是与实验 Z 相对照,证明H+ 对酯化反应具有催化作用。实验 Z 中应加入盐酸的体积 和浓度分别是______mL 和______mol/L
②分析实验______![]() 填实验编号
填实验编号![]() 的数据,可以推测出浓H2SO4 的吸水性提高了乙酸乙酯的产率。 浓硫酸的吸水性能够提高乙酸乙酯产率的原因是______。
的数据,可以推测出浓H2SO4 的吸水性提高了乙酸乙酯的产率。 浓硫酸的吸水性能够提高乙酸乙酯产率的原因是______。
③加热有利于提高乙酸乙酯的产率,但实验发现温度过高乙酸乙酯的产率反而降低,可能的原因是______
④分离出乙酸乙酯层后,经过洗涤,为了干燥乙酸乙酯可选用的干燥剂为______![]() 填字母
填字母![]() 。
。
A.P2O5 B.无水Na2SO4 C.碱石灰 D.NaOH 固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上,从精制黑钨矿(FeWO4、MnWO4)中提取金属钨的一种流程如下图所示,该流程同时获取副产物Fe2O3和MnCl2。

已知:I.过程①~④中,钨的化合价均不变;
Ⅱ.常温下钨酸难溶于水;
Ⅲ.25℃时,Ksp[Fe(OH)3]=1.0×10-38,Ksp [Mn(OH)2]=4.0×10-14
回答下列问题:
(1)上述流程中的“滤渣1”除MnO2外还有_____、“气体”除水蒸气、HCl外还有____(均填化学式);
(2)过程①中MnWO4参与反应的化学方程式为______;FeWO4参与的反应中氧化剂与还原剂的物质的量之比为___________;
(3)已知WO3(s)+3H2(g)=W(s)+3H2O(g) ΔH=a kJ·mol-1
WO3(s)=WO3(g) ΔH=b kJ·mol-1
写出WO3(g)与H2(g)反应生成W(s)的热化学方程式:_______;
(4)过程⑦在25℃时调pH,至少应调至_______(当离子浓度等于1.0×10-5mol·L-1时,可认为其已沉淀完全);
(5)过程⑧要获得MnCl2固体,在加热时必须同时采取的一项措施是__________;
(6)钠钨青铜是一类特殊的非化学计量比化合物,其通式为NaxWO3,其中0<x<1,这类化合物具有特殊的物理化学性质,是一种低温超导体。应用惰性电极电解熔融的Na2WO4和WO2混合物可以制备钠钨青铜,写出WO42-在阴极上放电的电极反应式:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溶液中的化学反应大多是离子反应。根据要求回答下列问题:
(1)Na2CO3溶液显碱性的原因,用离子反应方程式表示_____________________________;CuSO4溶液呈酸性的原因,用离子反应方程式表示:___________________________。
(2)25 ℃时,pH为9的CH3COONa溶液中c(OH-)=________。
(3)25 ℃时,将a mol·L-1氨水与0.01 mol·L-1盐酸等体积混合,反应平衡时溶液中c(NH![]() )=c(Cl-),则溶液显________(填“酸”“碱”或“中”)性。用含a的代数式表示NH3·H2O的电离常数Kb=___________。
)=c(Cl-),则溶液显________(填“酸”“碱”或“中”)性。用含a的代数式表示NH3·H2O的电离常数Kb=___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述错误的是( )
A.1molCH2=CH2先与HCl发生加成反应,再与Cl2发生取代反应,最多消耗Cl22.5mol
B.实验室中可用如图所示方法除去CH3CH3气体中的CH2=CH2气体
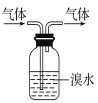
C.实验室中可用酸性的KMnO4溶液鉴别CH3CH3气体和CH2=CH2气体
D.工业上可利用CH2=CH2与HCl的加成反应制得纯净的CH3CH2Cl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com