
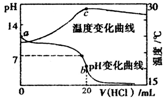
| A. | a点由水电离出的c(H+)<1.0×10-14mol•L-1 | |
| B. | b点时存在c(NH4+)+c(NH3•H2O)=c(C1-) | |
| C. | c点以后溶液温度下降的原因是盐酸的持续加入 | |
| D. | 在整个过程中可能会出现的离子浓度关系:c(NH4+)=c(C1-)>c(H+)=c(OH-) |
分析 A.一水合氨是弱电解质,部分电离,所以氨水中c(OH-)<1.000mol•L-1,氨水中水电离出的c(H+)=$\frac{{K}_{w}}{c(O{H}^{-})}$;
B.b点时,酸碱的物质的量相等,二者恰好完全反应生成氯化铵,根据物料守恒判断;
C.酸碱中和是放热反应,温度最高时为二者恰好完全反应时,继续加入稀盐酸导致溶液温度降低;
D.当溶液呈中性时存在c(H+)=c(OH-),根据电荷守恒得c(NH4+)=c(C1-),此时溶液中溶质为氯化铵和一水合氨,水的电离程度很小.
解答 解:A.一水合氨是弱电解质,部分电离,所以氨水中c(OH-)<1.000mol•L-1,氨水中水电离出的c(H+)=$\frac{{K}_{w}}{c(O{H}^{-})}$>$\frac{1{0}^{-14}}{1.000}$mol/L=1.0×10-14mol•L-1,故A错误;
B.b点时,酸碱的物质的量相等,二者恰好完全反应生成氯化铵,根据物料守恒得c(NH4+)+c(NH3•H2O)=c(C1-),故B正确;
C.酸碱中和是放热反应,温度最高时为二者恰好完全反应时,如果加入的盐酸温度大于该混合溶液温度会导致d点后溶液温度降低,所以继续加入稀盐酸是导致溶液温度降低的原因,故C正确;
D.当溶液呈中性时存在c(H+)=c(OH-),根据电荷守恒得c(NH4+)=c(C1-),此时溶液中溶质为氯化铵和一水合氨,水的电离程度很小,所以存在c(NH4+)=c(C1-)>c(H+)=c(OH-),故D正确;
故选A.
点评 本题考查酸碱混合溶液定性判断,为高频考点,侧重考查学生分析判断能力,明确溶液温度变化与溶液中溶质成分关系是解本题关键,知道图中各点溶液中溶质成分,题目难度中等.


 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钙 | B. | 硝酸钾 | C. | 高锰酸钾 | D. | 硝酸钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| CaSO4 | Mg2(OH)2CO3 | CaCO3 | BaSO4 | BaCO3 |
| 2.6×10-2 | 2.5×10-4 | 7.8×10-4 | 2.4×10-4 | 1.7×10-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 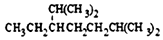 2,6-二甲基-5-乙基庚烷 | B. | 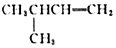 3-甲基-1-丁烯 | ||
| C. | 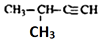 2-甲基-3-丁烯 | D. | 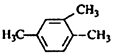 1,3,4-三甲苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同分异构现象只存在于有机物和无机物之间 | |
| B. | 同分异构现象不存在于无机物之间 | |
| C. | 在无机化合物和有机化合物间一定存在同分异构现象 | |
| D. | 在无机化合物和有机化合物间可能存在同分异构现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
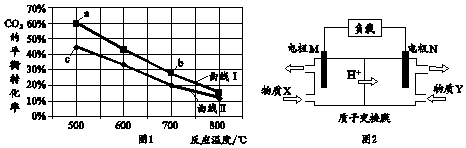
| A. | 图1中b点对应的平衡常数K值大于c点 | |
| B. | 图1中a点对应的H2的转化率等于30% | |
| C. | 图2中电极M上发生还原反应 | |
| D. | 图2中电极N的反应式:H2O2+2e-+6H+=2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制一定物质的量浓度溶液中,洗净的容量瓶要放进烘箱中烘干,以防溶液被稀释 | |
| B. | 测量Zn与稀硫酸反应速率的实验中,应在标准状况下测量H2的体积,以方便计算 | |
| C. | 酸碱滴定实验中,用待测溶液润洗锥形瓶,以减少实验误差 | |
| D. | 中和热的测定实验中,要用环形玻璃搅拌棒搅拌,使反应更充分 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molN2中含有的分子数为2×6.02×1023 | |
| B. | 用激光笔照射CuSO4溶液可产生“丁达尔效应” | |
| C. | 常温下,铝片能溶于浓硫酸 | |
| D. | 常温下,淀粉溶液遇I2变为蓝色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com