
| A. | 大力实施矿物燃料“脱硫、脱硝”技术,可减少酸雨的发生 | |
| B. | SiO2具有很好的导电性,可用于制取光导纤维 | |
| C. | 节日燃放的烟花,是碱金属、锶、铂、铁等金属化合物焰色反应所呈现的色彩 | |
| D. | CO、NO、NO2都是大气污染气体,在空气中都能稳定存在 |
分析 A.N、S的氧化物均可导致酸雨的发生;
B.SiO2不导电,对光具有良好的全反射作用;
C.铂、铁灼烧时均为无色;
D.NO易被氧化生成NO2.
解答 解:A.N、S的氧化物均可导致酸雨的发生,则大力实施矿物燃料“脱硫、脱硝”技术,可减少酸雨的发生,故A正确;
B.SiO2不导电,对光具有良好的全反射作用,则用于制取光导纤维,故B错误;
C.铂、铁灼烧时均为无色,则节日燃放的烟花,是碱金属、锶等金属化合物焰色反应所呈现的色彩,故C错误;
D.NO易被氧化生成NO2,则NO不能在空气中稳定存在,CO、NO、NO2都是大气污染气体,故D错误;
故选A.
点评 本题考查物质的性质,为高频考点,把握物质性质、反应与用途为解答的关键,侧重分析与应用能力的考查,注意化学与生活的联系,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
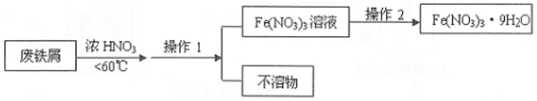
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO2和NO | B. | NO2和CO2 | C. | N2和O2 | D. | O2和CO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式为C5H11Cl的有机物,分子中含2个甲基的同分异构体有4种 | |
| B. | 甲苯与氯气在光照下反应主要生成2,4--二氯甲苯 | |
| C. | 苯酚、甲醛通过加聚反应可制得酚醛树脂 | |
| D. | 合成顺丁橡胶( 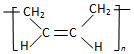 )的单体是CH3-CH=CH-CH3 )的单体是CH3-CH=CH-CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在酸性土地中 | |
| B. | 在潮湿疏松的土壤中 | |
| C. | 在干燥致密不透气的土壤中 | |
| D. | 在含碳粒较多,潮湿透气的中性土壤中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升温水的离子积增大 | |
| B. | pH=7的溶液一定显中性 | |
| C. | NaHSO4 溶液一定显酸性 | |
| D. | 用氢氧化钠溶液滴定硫酸溶液到滴定终点时,混合溶液不一定显中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
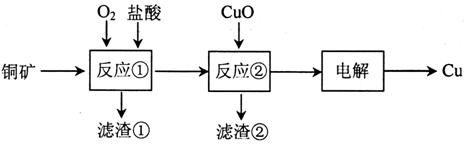
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com