
【题目】中药在世界医学界越来越受到关注。中药药剂砒霜(主要成分As2O3)可用于治疗急性白血病,为此,砷及其化合物的提取再次引起关注。
(1)As的原子结构示意图为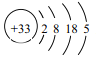 ,则其在周期表中的位置是______________________。
,则其在周期表中的位置是______________________。
(2)N元素非金属性比As强,下列说法正确的是___________________________。
①NH3的热稳定性比AsH3差 ②HNO3的酸性比H3AsO4强 ③N的原子半径比As的原子半径小
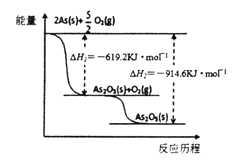
(3)根据下图写出As2O5分解为As2O3的热化学方程式______________________________________。
(4)查文献得知,可以从硫化砷(As2S3)废渣中提取As2O3,提取的工艺流程简图如下:

①As2S3、Na3AsS3中的S均为-2价,碱浸过程中发生的反应________(填“是”或“不是”)氧化还原反应。
②过程Ⅲ的系列操作包括________________________________________。
③写出过程Ⅲ的离子方程式_________________________________,过程Ⅲ中,酸性越强,As2O3的产率越高,请解释其原因________________________________。
【答案】(1)第四周期,VA族(2)②③
(3)As2O5(s)===As2O3(s)+O2(g)△H=+295.4kJ·mol-1
(4)①不是②浓缩结晶,过滤,洗涤,烘干③2AsO43-+2SO2+2H+===As2O3+2SO42-+H2O;酸性越强,物质的氧化性或者还原性可能增强;增加氢离子浓度平衡正向移动促进反应的进行,有利于提高As2O3的产率。
【解析】
试题(1)根据As的原子结构示意图可知,有4个电子层,在第四周期,最外层有5个电子,位于VA族。
(2)非金属性越强,气态氢化物热稳定性越强,最高价含氧酸的酸性越强,对同族元素来说,原子半径越小,答案选②③。
(3)根据图给数据,由As2O5分解为As2O3吸收热量为914.6-619.2=" +295.4" kJ·mol-1,所以反应的热化学方程式为As2O5(s) = As2O3(s) + O2(g) △H=" +295.4" kJ·mol-1。
(4)①As2S3、Na3AsS3中的S均为-2价,As为+3价,Na为+1价,生成物Na3AsO3中Na的化合价为+1价,As的化合价为+3价,S的化合价为-2价,所以所有元素的化合价没有发生变化,碱浸过程中发生的反应不是氧化还原反应。
②过程Ⅲ是由滤液得到固体的过程,所以系列操作包括浓缩结晶,过滤,洗涤,烘干。
③在过程Ⅲ中,Na3AsO4具有氧化性,SO2具有还原性,在酸性溶液中发生氧化还原反应,反应的离子方程式为2AsO4 3-+ 2SO2+ 2H+ ===As2O3 + 2SO42- + H2O。酸性越强,物质的氧化性或者还原性可能增强;增加氢离子浓度平衡正向移动促进反应的进行,有利于提高As2O3的产率,所以过程Ⅲ中,酸性越强,As2O3的产率越高。


 导学教程高中新课标系列答案
导学教程高中新课标系列答案 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:
【题目】下列各组离子一定能够大量共存的是
A.Na+、OH-、SO42-、Fe3+B.K+、SO42-、CO32-、H+
C.Na+、Ca2+、Cl-、CO32-D.Ba2+、Na+、NO3-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物I(分子式为C19H20O4)属于芳香酯类物质,是一种调香剂,其合成路线如下:

已知:①A属于脂肪烃,核磁共振氢谱显示有2组峰,面积比为3:1,其蒸汽在标准状况下密度为2.5g·L-1;D分子式为C4H8O3;E分子式为C4H6O2,能使溴水褪色。
② 其中R为烃基
其中R为烃基
③ 其中R1和R2均为烃基
其中R1和R2均为烃基
回答下列问题:
(1)A的结构简式为________________________________;
(2)反应④的化学方程式为_________________________________;
(3)E的同系物K比E多一个碳原子,K有多种链状同分异构体,其中能发生银镜反应且能水解的有______________种;
(4)反应①~⑦属于取代反应的是________________________(填序号);
(5)反应⑦的化学方程式为________________________________;
(6)参照上述合成路线,以  为原料(无机试剂任选),经4步反应制备可降解塑料
为原料(无机试剂任选),经4步反应制备可降解塑料 ________________________。
________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,将一定量碳酸氢铵固体置于容积不变密闭容器中,发生反应:
NH4HCO3(s)![]() NH3(g)+H2O(g)+CO2(g) △H=QkJ/mol(Q>0)。下列有关说法不正确的是
NH3(g)+H2O(g)+CO2(g) △H=QkJ/mol(Q>0)。下列有关说法不正确的是
A. 若容器内混合气体的密度不变,则说明反应达到平街状态
B. 若CO2体积分数不再发生变化,则说明反应达到平街状态
C. 若升高体系温度,则正、逆反应速率均增大
D. 若反应过程中吸收QkJ热量,则刚好有lmol NH4HCO3发生分解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 蛋白质溶液中加入饱和硫酸铵溶液,蛋白质发生变性
B. 全降解塑料![]() 可由环氧丙烷
可由环氧丙烷![]() 和CO2缩聚制得
和CO2缩聚制得
C. 用牛油制肥皂,当在反应液中加入热的饱和食盐水并搅拌后,会发现烧杯底部有固体物质析出
D. 在用油脂制肥皂实验中,加入乙醇是为了增大油脂和NaOH 溶液的接触面积,从而加快化学反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知断开1molH-H键吸收的能量为436KJ,形成1molH-N键放出的能量为391KJ,根据化学方程式N2+3H2![]() 2NH3,反应完1molN2放出的能量为924KJ,则断开1molN≡N键吸收的能量是
2NH3,反应完1molN2放出的能量为924KJ,则断开1molN≡N键吸收的能量是
A.431KJ B.649KJ C.869KJ D.945.6KJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某氯化钾样品中含有少量碳酸钾、硫酸钾和不溶于水的杂质。为了提纯氯化钾,先将样品溶于适量水中,充分搅拌后过滤,再将滤液按如图所示步骤进行操作。下列说法中正确的是
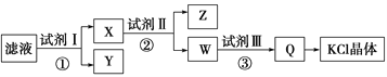
A. 起始滤液的pH=7
B. 试剂Ⅰ为Ba(NO3)2溶液
C. 步骤②中加入试剂Ⅱ的目的是除去Ba2+
D. 图示的步骤中必须要经过2次过滤操作
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质用途的说法正确的是
A. 稀硫酸用于除铁锈 B. 碳酸钠用于治疗胃酸过多
C. 晶体硅用于制造光导纤维 D. 硫酸钡用于制作石膏绷带
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com