
某课外小组对一些金属单质和化合物的性质进行研究。
(1)下表为“铝与氯化铜溶液反应”实验报告的一部分:
|
实验步骤 |
实验现象 |
|
①将打磨过的铝片(过量)放入一定浓度的CuCl2溶液中。 |
产生气泡,析出疏松的红色固体,溶液逐渐变为无色。 |
|
②反应结束后分离出溶液备用。 |
|
|
③红色固体用蒸馏水洗涤后,置于潮湿空气中。 |
一段时间后固体由红色变为绿色[视其主要成分为Cu2(OH)2CO3]。 |
按实验中发生反应的现象写出下列化学方程式(是离子反应的只写离子方程式)
①析出疏松的红色固体 ;
③一段时间后固体由红色变为绿色 。
(2)用石墨作电极,电解上述实验分离出的溶液,两极产生气泡。持续电解,在阴极附近的溶液中还可观察到的现象是 。
解释此现象的离子方程式是 、 。
(3)工业上可用铝与软锰矿(主要成分为MnO2)反应来治炼金属锰。
①用铝与软锰矿冶炼锰的原理是(用化学方程式表示)
。
②MnO2在H2O2分解反应中作催化剂。若将适量MnO2加入酸化后的H2O2溶液中,MnO2溶解产生Mn2+,该反应的离子方程式是 。
(1)①2Al+3Cu2+=2Al3++3Cu ③2Cu+O2+H2O+CO2=Cu2(OH)2CO3
(2)白色沉淀生成,后沉淀逐渐溶解至消失 Al3++3OH-=Al(OH)3↓ Al(OH)3+OH-=AlO2-+2H2O
(3)①3MnO2+4Al 3Mn+2Al2O3
②MnO2+H2O2+2H+=Mn2++O2↑+2H2O
3Mn+2Al2O3
②MnO2+H2O2+2H+=Mn2++O2↑+2H2O
【解析】
试题分析:(1)①置换反应就是一种单质与一种化合物反应,生成另一种单质和另一种化合物的反应,将打磨过的铝片放入氯化铜溶液中,析出红色固体,说明铝与氯化铜反应,铜被置换出来,同时生成氯化铝,该反应为置换反应,所以本题答案为:2Al+3CuCl2=3Cu+2AlCl3;
③化合反应就是由两种或两种以上的物质生成一种其他物质的化学反应,红色的铜放在潮湿的空气中变为绿色,是因为与氧气、二氧化碳、水共同作用生成了铜锈碱式碳酸铜,该反应为化合反应,所以本题答案为:2Cu+O2+CO2+H2O=Cu2(OH)2CO3
(2)用石墨作电极,电解AlCl3溶液,电极反应式阳极:2Cl--2e-=Cl2↑,阴极:2H++2e-=H2↑,破坏了H2O的电离平衡,使溶液呈碱性,Al3++3OH-=Al(OH)3↓,持续电解,Al(OH)3又溶于过量的碱,Al(OH)3+OH-=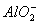 +2H2O。
+2H2O。
(4)铝与MnO2发生铝热反应,4Al+3MnO2 2Al2O3+3Mn。在酸性条件下MnO2具有氧化性,把H2O2氧化成O2,MnO2变成Mn2+。MnO2+H2O2+2H+=Mn2++2H2O+O2↑
2Al2O3+3Mn。在酸性条件下MnO2具有氧化性,把H2O2氧化成O2,MnO2变成Mn2+。MnO2+H2O2+2H+=Mn2++2H2O+O2↑
考点:考查金属性质及电解等相关知识。


 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:阅读理解
| 实验步骤 | 实验现象 |
| 将打磨过的铝片(过量)放入一定浓度的CuCl2溶液中 | 产生气泡,析出疏松的红色固体,溶液逐渐变为无色 |
反应结束后分离出溶液备用 |
|
| 红色固体用蒸馏水洗涤后,置于潮湿空气中 | 一段时间后固体由红色变为绿色[其主要成分为Cu2(OH)2CO3] |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤 | 实验现象 |
| 将打磨过的铝片(过量)放入一定浓度的CuCl2溶液中. | 产生气泡,析出疏松的红色固体,溶液逐渐变为无色. |
| 反应结束后分离出溶液备用 | |
| 红色固体用蒸馏水洗涤后,置于潮湿空气中. | 一段时间后固体由红色变为绿色[视其主要成分为Cu2(OH)2CO3] |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年湖南省高三第二次联考(10月)化学试卷(解析版) 题型:填空题
某课外小组对一些金属单质和化合物的性质进行研究。
(1)下表为“铝与氯化铜溶液反应”实验报告的一部分:
|
实验步骤 |
实验现象 |
|
①将打磨过的铝片(过量)放入一定浓度的CuCl2溶液中。 |
产生气泡,析出疏松的红色固体,溶液逐渐变为无色。 |
|
②反应结束后分离出溶液备用。 |
|
|
③红色固体用蒸馏水洗涤后,置于潮湿空气中。 |
一段时间后固体由红色变为绿色[视其主要成分为Cu2(OH)2CO3]。 |
按实验中发生反应的现象写出下列化学方程式(是离子反应的只写离子方程式)
①析出疏松的红色固体 ;
③一段时间后固体由红色变为绿色 。
(2)用石墨作电极,电解上述实验分离出的溶液,两极产生气泡。持续电解,在阴极附近的溶液中还可观察到的现象是 。
解释此现象的离子方程式是 、 。
(3)工业上可用铝与软锰矿(主要成分为MnO2)反应来治炼金属锰。
①用铝与软锰矿冶炼锰的原理是(用化学方程式表示)
。
②MnO2在H2O2分解反应中作催化剂。若将适量MnO2加入酸化后的H2O2溶液中,MnO2溶解产生Mn2+,该反应的离子方程式是 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年湖南省高三第二次联考(10月)化学试卷(解析版) 题型:填空题
某课外小组对一些金属单质和化合物的性质进行研究。
(1)下表为“铝与氯化铜溶液反应”实验报告的一部分:
|
实验步骤 |
实验现象 |
|
①将打磨过的铝片(过量)放入一定浓度的CuCl2溶液中。 |
产生气泡,析出疏松的红色固体,溶液逐渐变为无色。 |
|
②反应结束后分离出溶液备用。 |
|
|
③红色固体用蒸馏水洗涤后,置于潮湿空气中。 |
一段时间后固体由红色变为绿色[视其主要成分为Cu2(OH)2CO3]。 |
按实验中发生反应的现象写出下列化学方程式(是离子反应的只写离子方程式)
①析出疏松的红色固体 ;
③一段时间后固体由红色变为绿色 。
(2)用石墨作电极,电解上述实验分离出的溶液,两极产生气泡。持续电解,在阴极附近的溶液中还可观察到的现象是 。
解释此现象的离子方程式是 、 。
(3)工业上可用铝与软锰矿(主要成分为MnO2)反应来治炼金属锰。
①用铝与软锰矿冶炼锰的原理是(用化学方程式表示)
。
②MnO2在H2O2分解反应中作催化剂。若将适量MnO2加入酸化后的H2O2溶液中,MnO2溶解产生Mn2+,该反应的离子方程式是 。
查看答案和解析>>
科目:高中化学 来源:2013届辽宁省分校高二下学期期末考试化学试卷(解析版) 题型:实验题
(15分)某课外小组对一些金属单质和化合物的性质进行研究。
(1)下表为“铝与氯化铜溶液反应”实验报告的一部分:
|
实验步骤 |
实验现象 |
|
将打磨过的铝片过量放入一定浓度的CuCl2溶液中 |
产生气泡,析出疏松的红色固体,溶液逐渐变为无色 |
|
反应结束后分离出溶液备用 |
|
|
红色固体用蒸馏水洗涤后,置于潮湿空气中 |
一段时间后固体由红色变为绿色[视其主要成分为 |
|
Cu2OH2CO3 |
|
按反应类型写出实验中发生反应的化学方程式各一个是离子反应的只写离子方程式
置换反应____________,
化合反应____________。
(2)用石墨作电极,电解上述实验分离出的溶液,两极产生气泡。持续电解,在阴极附近的溶液中还可观察到的现象是______________________________________________。
解释此现象的离子方程式是_______________。
(3)工业上可用铝与软锰矿主要成分为MnO2反应来冶炼金属锰。
① 用铝与软锰矿冶炼锰的原理是用化学方程式表示_____________________________。
② MnO2在H2O2分解反应中作催化剂。若将适量MnO2加入酸化后的H2O2溶液中,MnO2溶解产生Mn2+,该反应的离子方程式______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com