
| A. | 属于两性氧化物 | B. | 能与氢氧化钠反应 | ||
| C. | 能与硫酸反应 | D. | 常温下能溶于水 |
分析 短周期元素X和元素Y,元素X原子的最外层电子数为a,次外层电子数为b;元素Y原子的M层电子数为(a-b),L层电子数为(a+b),则L层电子数为8,所以a+b=8,所以元素X原子有2个电子层,故b=2,所以a=8-b=8-2=6,故X为O元素;故元素Y原子的M层电子数为a-b=6-2=4,故Y为Si元素,X、Y两元素形成的化合物为SiO2.结合元素化合物的性质判断.
解答 解:短周期元素X和元素Y,元素X原子的最外层电子数为a,次外层电子数为b;元素Y原子的M层电子数为(a-b),L层电子数为(a+b),则L层电子数为8,所以a+b=8,所以元素X原子有2个电子层,故b=2,所以a=8-b=8-2=6,故X为O元素;故元素Y原子的M层电子数为a-b=6-2=4,故Y为Si元素,X、Y两元素形成的化合物为SiO2.
A.SiO2是酸性氧化物,故A错误;
B.SiO2与氢氧化钠反应生成硅酸钠与水,故B正确;
C.SiO2性质稳定,溶于HF酸,不溶于其它酸,与硫酸不反应,故C错误;
D、SiO2不与水反应,难溶于水,故D错误.
故选:B.
点评 本题考查结构位置关系、核外电子排布规律、二氧化硅的性质等,难度不大,根据电子排布规律推断元素是关键,注意二氧化硅性质的特殊性.


 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.1s | B. | 2.5s | C. | 5s | D. | 10s |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
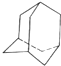 油田开采的石油中溶有一种碳氢化合物--金刚烷,它的分子立体结构如图所示:
油田开采的石油中溶有一种碳氢化合物--金刚烷,它的分子立体结构如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化铵与八水合氢氧化钡反应 | |
| B. | 碳与水蒸气高温制取水煤气 | |
| C. | 氢氧化钾和硫酸中和 | |
| D. | 碳酸钙高温分解成氧化钙和二氧化碳 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 电离能 | I1 | I2 | I3 | I4 | … |
| Im/kJ•mol-1 | 578 | 1817 | 2745 | 11578 | … |
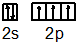 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
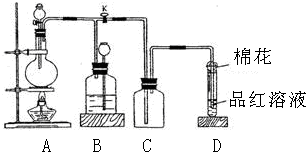
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气溶于水:H2O+Cl2═2H++ClOˉ+Clˉ | |
| B. | 锌片插入稀H2SO4溶液中:Zn+2H+═Zn2++H2↑ | |
| C. | 氢氧化钡溶液与稀硫酸反应:H++SO42-+OH-+Ba2+═H2O+BaSO4↓ | |
| D. | 碳酸钙溶于稀盐酸:CO32-+2H+═H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠在氧气中燃烧 | B. | NaOH溶液滴入NH4HCO3溶液 | ||
| C. | 稀硝酸中加入铁粉 | D. | 镁与H2SO4溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com