
【题目】以硫铁矿(主要成分为FeS2,还有少量CuS、SiO2等杂质)为原料制备绿矾晶体(FeSO4·7H2O)的工艺流程如下:
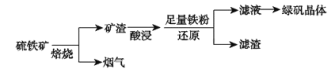
(1)“酸浸”过程,矿渣中的Fe2O3与稀H2SO4反应的离子方程式________。
(2)烟气中的SO2会污染环境,可用足量氨水吸收,写出该反应的离子方程式________。
(3)滤液中金属阳离子的检验方法__________。
(4)FeSO4溶液制备绿矾晶体过程中要保持H2SO4过量,理由________。(结合化学用语说明原因)
(5)燃料细菌脱硫法是用氧化亚铁硫杆菌(T.f)对硫铁矿进行催化脱硫,同时得到FeSO4溶液。其过程如图所示:
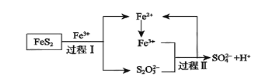
已知总反应为:FeS2+14Fe3++8H2O=2SO42-+15Fe2++16H+
①将过程I离子方程式补充完整______FeS2+______Fe3++_______ ______=7Fe2++______S2O32-+____ ______
②过程II反应的离子方程式________________________________________。
(6)绿矾晶体在空气中易被氧化。取X g样品,加水完全溶解,用酸化的amol·L-1K2Cr2O7溶液滴定至终点,消耗K2Cr2O7溶液b mL。反应原理:6Fe2++Cr2O72-+14H+ =6Fe3++2Cr3++7H2O。则绿矾晶体纯度的计算式为______________。(FeSO4·7H2O摩尔质量为278 g/mol)
【答案】Fe2O3 +6H+=2Fe3++3H2O SO2+2NH3H2O=2NH4++SO32-+H2O 取滤液少许于试管中,滴加K3[Fe(CN)6](铁氰化钾)溶液,有蓝色沉淀产生,证明滤液中含有Fe2+ Fe2++2H2OFe(OH)2 +2H+,H+过量抑制Fe2+的水解 1 6 3 H2O 1 6 H+ 8Fe3++S2O32-+5H2O=2SO42-+8Fe2++10H+ ![]()
【解析】
以硫铁矿(主要成分为FeS2,还有少量CuS、SiO2等杂质)为原料制备绿矾晶体(FeSO47H2O):焙烧硫铁矿:4FeS2+11O2=2Fe2O3+8SO2、2CuS+3O2=2CuO+2SO2,再酸浸矿渣:Fe2O3 +6H+=2Fe3++3H2O、CuO +2H+=Cu2++H2O,加入足量的铁粉:Fe+Cu2+=Fe2++Cu,过滤,滤渣为Cu、Fe、SiO2,滤液为FeSO4溶液,结晶得到绿矾晶体,
燃料细菌脱硫:过程I;FeS2+6Fe3++3H2O=7Fe2++S2O32-+6H+,将Fe2+氧化为Fe3+,过程II:8Fe3++S2O32-+5H2O=2SO42-+8Fe2++10H+,
根据反应原理,n(绿矾)=6n(K2Cr2O7),据此分析作答。
:(1)矿渣中的Fe2O3与稀H2SO4反应的离子方程式Fe2O3 +6H+=2Fe3++3H2O;
故答案为:Fe2O3 +6H+=2Fe3++3H2O;
(2)烟气中的SO2会污染环境,可用足量氨水吸收,反应为:SO2+2NH3H2O=2NH4++SO32-+H2O;
故答案为:SO2+2NH3H2O=2NH4++SO32-+H2O;
(3)滤液中金属阳离子为Fe2+,用铁氰化钾检验,具体方法为:取滤液少许于试管中,滴加K3[Fe(CN)6](铁氰化钾)溶液,有蓝色沉淀产生,证明滤液中含有Fe2+;
故答案为:取滤液少许于试管中,滴加K3[Fe(CN)6](铁氰化钾)溶液,有蓝色沉淀产生,证明滤液中含有Fe2+;
(4)FeSO4溶液制备绿矾晶体过程中要保持H2SO4过量的原因是:Fe2++2H2OFe(OH)2 +2H+,H+过量抑制Fe2+的水解;
故答案为:Fe2++2H2OFe(OH)2 +2H+,H+过量抑制Fe2+的水解;
(5)①由图可知,过程I为FeS2和Fe3+生成Fe2+和S2O32-,结合电荷守恒、原子守恒可得:FeS2+6Fe3++3H2O=7Fe2++S2O32-+6H+;
故答案为:1;6;3;H2O;1;6;H+;
②过程Ⅱ反应为Fe3+与S2O32-反应生成SO42-和氢离子、Fe2+,反应为:8Fe3++S2O32-+5H2O=2SO42-+8Fe2++10H+;
故答案为:8Fe3++S2O32-+5H2O=2SO42-+8Fe2++10H+;
(6)原理:6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O,则n(FeSO47H2O)=6n(K2Cr2O7)=6ab×10-3mol,
故绿矾晶体纯度为![]()
故答案为:![]()


科目:高中化学 来源: 题型:
【题目】实验室使用pH传感器来测定![]() 和
和![]() 混合物中
混合物中![]() 的含量,称取
的含量,称取![]() 样品,溶于水配成
样品,溶于水配成![]() 溶液,取出该溶液
溶液,取出该溶液![]() 用
用![]() 盐酸滴定,得到图曲线.下列说法不正确的是
盐酸滴定,得到图曲线.下列说法不正确的是![]()
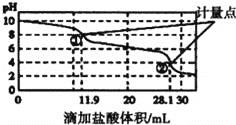
A.此样品![]()
B.计量点![]() 溶液中大量存在的阴离子是
溶液中大量存在的阴离子是![]()
C.计量点![]() 之间发生反应的离子方程式为
之间发生反应的离子方程式为![]()
D.使用该方法测定![]() 和NaOH混合溶液中的NaOH含量,将会得到1个计量点
和NaOH混合溶液中的NaOH含量,将会得到1个计量点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用![]() 表示阿伏加德罗常数的值,下列叙述正确的是( )
表示阿伏加德罗常数的值,下列叙述正确的是( )
A.![]() 个
个![]() 胶体粒子的质量为78g
胶体粒子的质量为78g
B.![]() g
g![]() 和CuO的混合物中含有铜原子数为
和CuO的混合物中含有铜原子数为![]()
C.在![]() 的碳酸钠溶液中,阴离子总数一定大于
的碳酸钠溶液中,阴离子总数一定大于![]()
D.标准状况下,![]() L己烷中共价键数目为
L己烷中共价键数目为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水中的溶解氧是水生生物生存不可缺少的条件。某课外小组设计如图所示的实验装置![]() 夹持装置略
夹持装置略![]() ,采用碘量法测定学校周边河水中的溶解氧的含量。
,采用碘量法测定学校周边河水中的溶解氧的含量。
实验步骤及测定原理如下:

Ⅰ.取样、氧的固定
![]() 用溶解氧瓶采集水样,记录大气压及水体温度。
用溶解氧瓶采集水样,记录大气压及水体温度。
![]() 向烧瓶中加入200mL水样。
向烧瓶中加入200mL水样。
![]() 向烧瓶中依次迅速加入
向烧瓶中依次迅速加入![]() 无氧溶液
无氧溶液![]() 过量
过量![]() 和2mL碱性KI无氧溶液
和2mL碱性KI无氧溶液![]() 过量
过量![]() ,开启搅拌器,反应生成
,开启搅拌器,反应生成![]() ,实现氧的固定。
,实现氧的固定。
Ⅱ![]() 酸化、滴定
酸化、滴定
![]() 搅拌,并向烧瓶中加入2mL硫酸无氧溶液至
搅拌,并向烧瓶中加入2mL硫酸无氧溶液至![]() 被
被![]() 还原为
还原为![]() ,溶液为中性或弱酸性。
,溶液为中性或弱酸性。
![]() 在暗处静置5min后,取一定量溶液,用
在暗处静置5min后,取一定量溶液,用![]() 标准溶液滴定生成的
标准溶液滴定生成的![]() ,记录数据。
,记录数据。
![]()
![]() 处理数据
处理数据![]() 忽略氧气从水样中的逸出量和加入试剂后水样体积的变化
忽略氧气从水样中的逸出量和加入试剂后水样体积的变化![]() 。
。
回答下列问题:
![]() 配制以上无氧溶液时,除去所用溶剂水中的氧气的简单操作为________。
配制以上无氧溶液时,除去所用溶剂水中的氧气的简单操作为________。
![]() 取水样时应尽量避免扰动水体表面,这样操作的主要目的是________。
取水样时应尽量避免扰动水体表面,这样操作的主要目的是________。
![]() “步骤c”中“搅拌”的作用是________。
“步骤c”中“搅拌”的作用是________。
![]() “氧的固定”中发生主要反应的化学方程式为________。
“氧的固定”中发生主要反应的化学方程式为________。
![]() “步骤f”为________。
“步骤f”为________。
![]() “步骤e”中,用amol/LNa2S2O3标准溶液滴定,以淀粉溶液作指示剂,滴定终点的现象为________;若200mL水样经处理后,共消耗
“步骤e”中,用amol/LNa2S2O3标准溶液滴定,以淀粉溶液作指示剂,滴定终点的现象为________;若200mL水样经处理后,共消耗![]() 标准溶液的体积为bmL,则水样中溶解氧的含量为________
标准溶液的体积为bmL,则水样中溶解氧的含量为________![]() 用含字母的式子表示)mg/L。
用含字母的式子表示)mg/L。
![]() “步骤d”中加入硫酸溶液反应后,若溶液pH过低,滴定时会产生明显的误差,写出产生此误差的原因
“步骤d”中加入硫酸溶液反应后,若溶液pH过低,滴定时会产生明显的误差,写出产生此误差的原因![]() 用离子方程式表示,至少写出2个
用离子方程式表示,至少写出2个![]() :________。
:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氰化钠![]() 是重要的化工原料,易溶于水,易水解生成氰化氢,剧毒物质。常用于电镀、冶金、有机合成医药、络合剂和掩蔽剂。
是重要的化工原料,易溶于水,易水解生成氰化氢,剧毒物质。常用于电镀、冶金、有机合成医药、络合剂和掩蔽剂。
![]() 装氰化钠
装氰化钠![]() 试剂瓶的标签上应印有下列警示标记中的________
试剂瓶的标签上应印有下列警示标记中的________![]() 填序号
填序号![]() 。
。

![]() 实验室用NaCN固体配制NaCN溶液时,为避免其水解,应先将其溶于______________浓溶液,再用蒸馏水稀释。
实验室用NaCN固体配制NaCN溶液时,为避免其水解,应先将其溶于______________浓溶液,再用蒸馏水稀释。
![]() 泄漏时用双氧水处理以减轻环境污染,处理后生成一种酸式盐和一种能使湿润的红色石蕊试纸变蓝的气体,该反应的离子方程式是__________________________________________。
泄漏时用双氧水处理以减轻环境污染,处理后生成一种酸式盐和一种能使湿润的红色石蕊试纸变蓝的气体,该反应的离子方程式是__________________________________________。
![]() 化学兴趣小组利用:2NH
化学兴趣小组利用:2NH![]() 反应原理制备NaCN并检测其纯度。
反应原理制备NaCN并检测其纯度。
实验一:制备NaCN装置如图所示
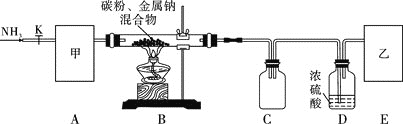
![]() 装置C的作用是____________。甲可选取下列装置中的________
装置C的作用是____________。甲可选取下列装置中的________![]() 填序号
填序号![]() 。
。

![]() 安装好实验仪器,检查装置气密性,取一定量的碳粉与金属钠混合,放入硬质玻璃管内;接下来的操作正确的是________
安装好实验仪器,检查装置气密性,取一定量的碳粉与金属钠混合,放入硬质玻璃管内;接下来的操作正确的是________![]() 填序号
填序号![]() 。
。
A.先打开活塞K,缓缓通入一段时间氨气后再加热硬质玻璃管
B.先加热硬质玻璃管,再打开活塞K,缓缓通入氨气
C.打开活塞K,一边缓缓通入氨气,同时加热硬质玻璃管
![]() 上述装置中乙处还需补充的实验仪器或装置有__________________。
上述装置中乙处还需补充的实验仪器或装置有__________________。
实验二:测定产品中氰化钠的含量
![]() 已知: Ag
已知: Ag![]() ,Ag
,Ag![]() ,AgI呈黄色,且CN
,AgI呈黄色,且CN![]() 优先与Ag
优先与Ag![]() 反应。取制备好的产品
反应。取制备好的产品![]() ,配成
,配成![]() 溶液,取
溶液,取![]() 于锥形瓶中,并滴加
于锥形瓶中,并滴加![]() 滴KI溶液作指示剂,用
滴KI溶液作指示剂,用![]() 的标准AgNO
的标准AgNO![]() 溶液滴定3次,平均消耗AgNO
溶液滴定3次,平均消耗AgNO![]() 溶液的体积为
溶液的体积为![]() 。滴定终点的现象是____________________________________________________________,产品氰化钠的纯度为________
。滴定终点的现象是____________________________________________________________,产品氰化钠的纯度为________![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D是四种短周期元素,E是过渡元素,A、B、C同周期,C、D同主族,A原子M层电子数是L层的一半,B是同周期第一电离能最小的元素,C在同周期中未成对电子数最多,E的外围电子排布式为3d64s2。回答下列问题:
(1)写出下列元素的名称:A __ B___ C ___ D ___
(2)上述五种元素中最高价氧化物对应水化物酸性最强的是(用化学式表示,下同)____,碱性最强的是______ 。
(3)D所在周期第一电离能最小的元素是_____,电负性最大的元素是_____。(填元素符号)
(4)D的氢化物比C的氢化物的沸点__(填“高”或“低”),原因是 ___________。
(5)E元素原子的核电荷数是____,E元素在周期表的位置是 _____,E元素处于周期表分区中的____区。
(6)画出D的核外电子排布图________,E的外围电子排布图_________。
(7)用电子式表示B的硫化物的形成过程:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素a、b、c、d的原子序数依次增大。其中A为d元素组成的单质;甲、乙、丙、丁、戊为上述四种元素组成的二元或三元化合物,常温下乙为液体。下列说法正确的是
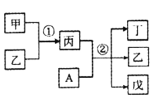
A.简单离子半径:c >b
B.反应①为吸热反应
C.②在常温下反应时,氧化剂与还原剂物质的量之比为1:1
D.b、d分别与a形成的化合物中,化学键类型一定完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如图所示。下列说法正确的是( )
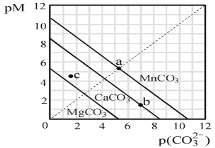
已知pM=-lgc(M),p(CO![]() )=-lgc(CO
)=-lgc(CO![]() )。
)。
A.MgCO3、CaCO3、MnCO3的Ksp依次增大
B.a点可表示MnCO3的饱和溶液,且c(Mn2+)=c(CO![]() )
)
C.b点可表示CaCO3的饱和溶液,且c(Ca2+)<c(CO![]() )
)
D.c点可表示MgCO3的过饱和溶液,且c(Mg2+)<c(CO![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有甲、乙、丙、丁、戊5种物质,在一定条件下,它们能按下图方式进行转化:

其推断正确的是
选项 | 甲 | 乙 | 丙 | 丁 | 戊 |
A | NH3 | O2 | NO | H2O | NO2 |
B | Mg | CO2 | C | MgO | CO |
C | C | H2O | CO | H2 | HCOOH |
D | FeBr2 | Cl2 | FeCl2 | Br2 | FeCl3 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com