
分析 (1)在水溶液里或熔融状态下能导电的化合物是电解质,在水溶液里和熔融状态下都不导电的化合物是非电解质,含有自由移动电子或离子的物质能导电;
(2)有色电解质溶液中,一定含Cu2+,则一定没有OH-,由溶液为电中性可知,阴离子一定为Cl-,则没有Ag+,以此来解答.
解答 解:(1)②⑤在水溶液里或熔融状态下能电离出阴阳离子而使其水溶液或熔融状态导电,所以属于电解质;
①的水溶液能电离出阴阳离子的是碳酸,所以二氧化碳是非电解质,
③⑤含有自由移动的离子,④中含有自由移动的电子,所以能导电;
③氨水是混合物,④铜是单质,所以氨水和铜既不是电解质也不是非电解质.
故答案为:②⑤;①;③④⑤;
(2)有色电解质溶液中,一定含Cu2+,则一定没有OH-,由溶液为电中性可知,阴离子一定为Cl-,则没有Ag+,综上所述,一定含Cu2+、Cl-,一定不含Ag+、OH-,可能含H+,
故答案为:Ag+、OH-;H+.
点评 本题考查了电解质、非电解质的概念及导电性、离子的推断等知识,为高频考点,侧重考查学生的分析能力和实验能力,较基础,注意离子推断中离子的共存及电中性原则.


 阶梯计算系列答案
阶梯计算系列答案科目:高中化学 来源: 题型:选择题
| A. | C5H11Br有7 种同分异构体 | |
| B. | 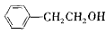 能发生取代、加成、氧化、消去等反应 能发生取代、加成、氧化、消去等反应 | |
| C. | 合成纤维和光导纤维都是新型无机非金属材料 | |
| D. | 溴丙烷水解制丙醇和丙烯与水反应制丙醇的反应类型相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3g ${\;}_{1}^{3}$H发生核反应:${\;}_{1}^{2}H$+${\;}_{1}^{3}H$→${\;}_{2}^{4}He$+${\;}_{0}^{1}n$,净产生的中子数为NA | |
| B. | 0.1L1mol/L盐酸含有的H+的数目为0.1NA | |
| C. | 标准状况下,22.4LCCl4含有的原子数目为5 NA | |
| D. | 1L0.4mol/L浓盐酸与足量的MnO2反应转移电子的物质的量为0.2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等于20% | B. | 大于20% | C. | 小于20% | D. | 无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)已知25℃和101kPa时
(1)已知25℃和101kPa时| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.50 | n1 | 0.34 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.10 | 0.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com