
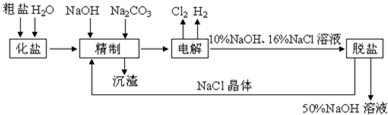
分析 (1)电解食盐水,与正极相连为阳极,生成氯气,与电源负极相连为阴极,生成氢气和NaOH;
(2)Ca2+、Mg2+等杂质与碳酸钠、NaOH反应转化为沉淀;
(3)添加钡试剂除去SO42-,注意不能引入新的杂质;
(4)有效除去Ca2+、Mg2+、SO42-,应注意碳酸钠在钡试剂之后.
解答 解:(1)电解食盐水,与正极相连为阳极,生成氯气,该电极反应为2Cl--2e-═Cl2↑,与电源负极相连为阴极,生成氢气和NaOH,生成碱,所以pH增大,
故答案为:2Cl--2e-═Cl2↑;增大;
(2)Ca2+、Mg2+等杂质与碳酸钠、NaOH反应转化为沉淀,离子反应分别为Ca2++CO32-═CaCO3↓、Mg2++2OH-═Mg(OH)2↓,
故答案为:Ca2++CO32-═CaCO3↓、Mg2++2OH-═Mg(OH)2↓;
(3)添加钡试剂除去SO42-,注意不能引入新的杂质,选Ba(NO3)2会引入杂质硝酸根离子,所以选ac,
故答案为:ac;
(4)有效除去Ca2+、Mg2+、SO42-,应注意碳酸钠在钡试剂之后,是为除去过量的钡离子,显然只有选项②符合,
故答案为:②.
点评 本题考查粗盐提纯及电解原理,明确发生的离子反应及电解反应是解答的关键,注意除杂不能引入新的杂质及试剂的添加顺序,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 它的式量为720 | |
| B. | 它是一种单质 | |
| C. | 它是一种新型的共价化合物 | |
| D. | 它在氧气中燃烧的产物和碳在氧气中燃烧的产物相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 形成1 mol H-Cl键放出的能量 | |
| B. | 石墨转变成金刚石吸收的能量 | |
| C. | 1 mol O2形成2 mol O原子吸收的能量 | |
| D. | 水蒸气变成液态水放出的能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 其水溶液显强酸性,俗称石炭酸 | |
| B. | 其浓溶液对皮肤有强烈的腐蚀性,如果不慎沾在皮肤上,应立即用NaOH擦洗 | |
| C. | 其在水中的溶解度随温度的升高而增大,超过65℃可以与水以任意比互溶 | |
| D. | 碳酸氢钠溶液中滴入苯酚的水溶液后立即放出二氧化碳 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在空气中,金属铝表面迅速氧化形成保护层 | |
| B. | 红热的铁丝与水接触,表面形成蓝黑色的保护层 | |
| C. | 常温下,浓硫酸使铝、铁等金属钝化 | |
| D. | 白铁(镀锌)表面有划伤时,仍然不易生锈 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向水中加少量NaHSO4 | B. | 向水中加少量FeCl3 | ||
| C. | 向水中加少量Na2CO3 | D. | 将纯水加热到90℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com