
分析 【猜想】(2)根据NaHCO3不稳定,受热易分解,而Na2CO3受热不易分解角度分析;
【问题讨论】(1)CaCl2与Na2CO3溶液反应生成碳酸钙沉淀和氯化钠,据此写出反应的离子方程式;
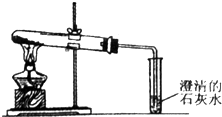
(2)装置中含有空气,加热时空气受热膨胀,所以开始会产生少量气泡;在加热NaHCO3固体时,碳酸氢钠分解生成碳酸钠、二氧化碳气体和水,据此判断反应现象;
(3)碳酸钠、碳酸氢钠与盐酸反应时产生氢气的速率不同,可以用盐酸鉴别碳酸钠和碳酸氢钠;碳酸氢钠直接与盐酸反应生成二氧化碳气体,而碳酸钠与盐酸先生成碳酸氢钠,所以加入碳酸氢钠的气球膨胀比较快;根据n=$\frac{m}{M}$及碳原子守恒可知,碳酸氢钠的摩尔质量较小,则等质量时碳酸氢钠放出的氢气多,则氢气比较大;
【拓展应用】(1)要除去Na2CO3溶液中混有的少量NaHCO3,除杂不能引进新的杂质,可以加入适量的强氧化钠;
(2)测定Na2CO3与NaHCO3固体混合物中Na2CO3,可通过以下方法:方案一:称取5 g 样品于坩埚(已称量)加热至无水蒸气逸出,冷却、称 量加热后样品与坩埚的质量,重复至恒重;方案二:称取5 g 样品于已称质量的烧杯中,加入已称质量的50mL 2mol/L的硫酸,充分搅拌后,静置,称量烧杯(含反应后溶液)的质量至恒重;方案三:称取5 g 样品于已称质量的烧杯中,加入50mL 2mol/L的氢氧化钡溶液,充分搅拌后,静置,过滤、洗涤、烘干沉淀,冷却称量沉淀的质量;方案四:称取5 g 样品于烧杯中,加入50mL 蒸馏水,充分搅拌后,称量烧杯(含溶液)的质量,然后通入纯净干燥的二氧化碳,充分反应后,再称量至恒重.
解答 解:【猜想】(2)由于NaHCO3不稳定,受热易分解,而Na2CO3受热不易分解,所以Na2CO3、NaHCO3可用加热的方法鉴别,
故答案为:NaHCO3不稳定,受热易分解,而Na2CO3受热不易分解;
【问题讨论】(1)CaCl2与Na2CO3溶液反应生成碳酸钙沉淀和氯化钠,反应的离子方程式为:CO32-+Ca2+=CaCO3↓,
故答案为:CO32-+Ca2+=CaCO3↓;
(2)装置中由有空气,所以乙同学在加热Na2CO3固体时,空气受热膨胀,所以开始会产生少量气泡;在加热NaHCO3固体时,碳酸氢钠分解生成碳酸钠、二氧化碳气体和水,二氧化碳能够使澄清石灰水变浑浊,所以乙同学观察到的实验现象为:澄清石灰水变浑浊、小试管中有大量气泡产生、大试管管口有水珠等,
故答案为:空气受热膨胀;澄清石灰水变浑浊、小试管中有大量气泡产生、大试管管口有水珠等(写出两个现象即可);
(3)碳酸钠、碳酸氢钠与盐酸反应时产生氢气的速率不同,可以用盐酸鉴别碳酸钠和碳酸氢钠,所以丙的结论错误;丁同学认为对实验方案做一些改进,可用于鉴别碳酸钠与碳酸氢钠,方法为:称取各2.1g 两种固体,放入两个容积一样的气球中,在两只锥形瓶中各加入约25mL 2mol/L 的盐酸,分别将气球套在锥形瓶瓶口上,同时将气球中的固体同时倒入锥形瓶中,碳酸氢钠直接与盐酸反应生成二氧化碳气体,而碳酸钠与盐酸先生成碳酸氢钠,所以加入碳酸氢钠的气球膨胀比较快;根据n=$\frac{m}{M}$及碳原子守恒可知,碳酸氢钠的摩尔质量较小,则等质量时碳酸氢钠放出的氢气多,则氢气比较大,
故答案为:快;大;
【拓展应用】(1)要除去Na2CO3溶液中混有的少量NaHCO3,为了不引进新的杂质,可以加入适量的强氧化钠,
故答案为:NaOH(或氢氧化钠);
(2)测定Na2CO3与NaHCO3固体混合物中Na2CO3的质量分数的方法有:方案一:称取5 g 样品于坩埚(已称量)加热至无水蒸气逸出,冷却、称 量加热后样品与坩埚的质量,重复至恒重;方案二:称取5 g 样品于已称质量的烧杯中,加入已称质量的50mL 2mol/L的硫酸,充分搅拌后,静置,称量烧杯(含反应后溶液)的质量至恒重;方案三:称取5 g 样品于已称质量的烧杯中,加入50mL 2mol/L的氢氧化钡溶液,充分搅拌后,静置,过滤、洗涤、烘干沉淀,冷却称量沉淀的质量;方案四:称取5 g 样品于烧杯中,加入50mL 蒸馏水,充分搅拌后,称量烧杯(含溶液)的质量,然后通入纯净干燥的二氧化碳,充分反应后,再称量至恒重,
故答案为:方案一:称取5 g 样品于坩埚(已称量)加热至无水蒸气逸出,冷却、称 量加热后样品与坩埚的质量,重复至恒重;方案二:称取5 g 样品于已称质量的烧杯中,加入已称质量的50mL 2mol/L的硫酸,充分搅拌后,静置,称量烧杯(含反应后溶液)的质量至恒重;方案三:称取5 g 样品于已称质量的烧杯中,加入50mL 2mol/L的氢氧化钡溶液,充分搅拌后,静置,过滤、洗涤、烘干沉淀,冷却称量沉淀的质量;方案四:称取5 g 样品于烧杯中,加入50mL 蒸馏水,充分搅拌后,称量烧杯(含溶液)的质量,然后通入纯净干燥的二氧化碳,充分反应后,再称量至恒重.
点评 本题考查了性质实验方案的设计,题目难度中等,熟练掌握碳酸钠、碳酸氢钠的化学性质为解答关键,注意掌握性质实验方案设计与评价的原则,试题培养了学生的分析、理解能力及化学实验能力.


科目:高中化学 来源: 题型:解答题
 某同学想研究氨基酸的分离和鉴定的方法,已知实验室中有0.5%的赖氨酸、脯氨酸、缬氨酸、苯丙氨酸、亮氨酸溶液以及它们的混合液(各组份浓度均为0.5% );现提供如下器材和试剂:
某同学想研究氨基酸的分离和鉴定的方法,已知实验室中有0.5%的赖氨酸、脯氨酸、缬氨酸、苯丙氨酸、亮氨酸溶液以及它们的混合液(各组份浓度均为0.5% );现提供如下器材和试剂:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 (1)写出葡萄糖发生银镜反应的化学方程式CH2OH(CHOH)4CHO+2Ag(NH3)2OH $\stackrel{加热}{→}$CH2OH(CHOH)4COONH4+2Ag↓+3NH3+H2O.
(1)写出葡萄糖发生银镜反应的化学方程式CH2OH(CHOH)4CHO+2Ag(NH3)2OH $\stackrel{加热}{→}$CH2OH(CHOH)4COONH4+2Ag↓+3NH3+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓H2SO4滴在白纸上发黑,说明弄浓H2SO4具有脱水性 | |
| B. | 浓H2SO4和浓HCl混合可制氯化氢,说明浓H2SO4具有吸水性 | |
| C. | 常温下,浓H2SO4可以用铝罐贮存,说明铝与浓H2SO4不反应 | |
| D. | 反应CuSO4+H2S→CuS+H2SO4能在溶液中完全进行,证明CuS既不溶于水也不溶于稀H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH | B. | Na2SO4 | C. | HCl | D. | NH4Cl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com