
分析 根据n=$\frac{m}{M}$计算mgNa2CO3 的物质的量,根据方程式计算溶液中n(HCl)、生成的二氧化碳的物质的量,根据c=$\frac{n}{V}$计算盐酸的物质的量浓度,则若当盐酸溶液的物质的量浓度大于上述X值时,说明等质量时杂质消耗的HCl比碳酸钠消耗的HCl的量大,然后根据K2CO3、NaCl消耗的盐酸比碳酸钠少,NaOH比碳酸钠消耗的盐酸多得出正确结论.
解答 解:纯Na2CO3 m g与20mL盐酸恰好完全反应生成正盐,反应的化学方程式为:Na2CO3+2HCl=2NaCl+CO2↑+H2O,反应消耗的HCl的物质的量为:n(HCl)=2n(Na2CO3)=2×$\frac{mg}{106g/mol}$=$\frac{m}{53}$mol,
则此盐酸的物质的量浓度为:c(HCl)=$\frac{\frac{m}{53}mol}{0.02L}$=$\frac{50m}{53}$mol/L;Na2CO3不纯,杂质可能是K2CO3、NaCl和NaOH中某一种,当用上述盐酸反应时,则若当盐酸溶液的物质的量浓度大于上述X值时,说明等质量时杂质消耗的HCl比碳酸钠消耗的HCl的量大,
根据反应方程式K2CO3+2HCl=2KCl+CO2↑+H2O可知,Na2CO3与K2CO3消耗盐酸的物质的量关系相同,由于K2CO3的摩尔质量大于Na2CO3,则等物质的量时K2CO3消耗的盐酸体积偏小,即:杂质为K2CO3时,盐酸的浓度小于X,所以K2CO3不符合条件;
NaCl不与盐酸反应,所以含有杂质氯化钠时,盐酸的浓度小于X,所以NaCl也不符合要求;
当杂质为NaOH时,NaOH与HCl反应的方程式为:NaOH+HCl=NaCl+H2O,设质量都是106g,106gK2CO3消耗2molHCl,而106gNaOH消耗HCl的物质的量为:$\frac{106g}{40g/mol}$=$\frac{53}{20}$mol>2mol,即:杂质为NaOH时,盐酸的浓度小于X,所以杂质为NaOH符号条件,
故答案为:$\frac{50m}{53}$;NaOH.
点评 本题考查了有关物质的量浓度的计算、利用化学方程式的计算,题目难度中等,注意掌握物质的量与摩尔质量、物质的量浓度之间的转化关系,第二问中需要通过讨论完成,注意掌握通过讨论法解答化学计算题的方法与技巧.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
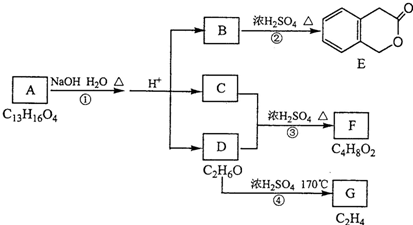
 .反应①的反应类型是水解反应或取代反应.
.反应①的反应类型是水解反应或取代反应.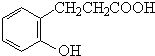 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4g氢氧化钠溶于水,电离出的离子总数为2NA | |
| B. | 35.5g氯气中所含的原子数为2NA | |
| C. | 0.1mol钠变成钠离子时,失去的电子数目0.1NA | |
| D. | 实验室制氯气,得到2.24L(标准状况下)氯气时电子转移数0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠融化成银白色小球 | B. | 小球在液面上快速游动 | ||
| C. | 溶液底部出现银白色固体 | D. | 溶液变浑浊 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
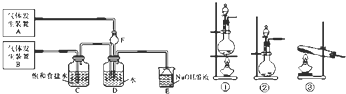
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
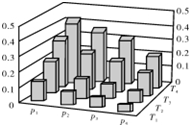
| A. | P1>P2>P3>P4 | |
| B. | 甲醇的物质的量分数越高,反应的平衡常数越大 | |
| C. | 若T1>T2>T3>T4,则该反应为放热反应 | |
| D. | 缩小容积,可以提高CH3OH在混合物中的质量分数 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com