
| A. | 乙酸和乙醇 | B. | 乙酸乙酯和碳酸钠溶液 | ||
| C. | 溴苯和苯 | D. | 汽油和煤油 |
科目:高中化学 来源: 题型:选择题
| A. | 若降低温度,可以加快反应速率 | |
| B. | 增大O2浓度可以增大反应速率 | |
| C. | 随着反应的进行,正反应速率逐渐减小,最后变为0 | |
| D. | 达到化学平衡状态时,SO2和SO3的浓度一定相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 碳、镁、镍在工业生产和科研领域有广泛用途.请回答下列问题:
碳、镁、镍在工业生产和科研领域有广泛用途.请回答下列问题: )等.
)等. 是常用的分析试剂.其中位于同周期的三种基态原子第一电离能由小到大的顺序为C<O<N(用元素符号表示);这三种元素形成的一种离子与CS2互为等电子体,该离子符号为OCN-.
是常用的分析试剂.其中位于同周期的三种基态原子第一电离能由小到大的顺序为C<O<N(用元素符号表示);这三种元素形成的一种离子与CS2互为等电子体,该离子符号为OCN-.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用布袋购物、以步代车属于“低碳生活”方式 | |
| B. | 饮用水中矿物质的含量越高越有利于人体健康 | |
| C. | 绿色化学的核心是利用化学原理从源头上减少和消除工业生产对环境的污染 | |
| D. | 采用光触媒技术可将汽车尾气中的NO和CO转化为无毒气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 编号溶液 | 1 | 2 | 3 | 4 |
| KMnO4(mL) | 20.01 | 19.00 | 19.99 | 20.00 |
| Na2SO3(mL) | 25.00 | 25.00 | 25.00 | 25.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
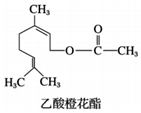 乙酸橙花酯是一种食用香料,其结构简式如图,关于该有机物的叙述中正确的是( )
乙酸橙花酯是一种食用香料,其结构简式如图,关于该有机物的叙述中正确的是( )| A. | ②④⑤ | B. | ①④⑤ | C. | ②③⑥ | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稳定性:NH3>PH3>AsH3 | B. | 离子半径:Li+>O2->F- | ||
| C. | 酸性:H3PO4<H2SO4<HClO4 | D. | 碱性:LiOH<NaOH<KOH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com