
| A. | 0.92g | B. | 0.69g | C. | 0.64g | D. | 0.23g |
分析 将一定量的钠铝合金置于水中,合金全部溶解,得到20mL pH=14的溶液,溶液呈碱性,故溶液中溶质为氢氧化钠、偏铝酸钠,向溶液中加入lmol•L-1的盐酸滴定,至沉淀质量最大时,此时溶液中溶质为氯化钠,根据溶液中电荷守恒可知n(Na+)=n(Cl-),据此进行计算.
解答 解:将一定量的钠铝合金置于水中,合金全部溶解,得到20mLpH=14的溶液,溶液呈碱性,故溶液中溶质为氢氧化钠、偏铝酸钠,向溶液中加入lmol•L-1的盐酸滴定,至沉淀质量最大时,此时溶液中溶质为氯化钠,
根据溶液中电荷守恒可知:n(Na+)=n(Cl-)=0.04mol×1mol/L=0.04mol,根据钠元素守恒可知原合金中钠为0.4mol,
所以原合金中钠的质量为:0.04mol×23g/mol=0.92g,
故选A.
点评 本题考查钠铝及其化合物的性质、根据方程式的计算,题目难度中等,根据反应实质及质量守恒得出n(Na+)=n(Cl-)是解题关键,试题培养了学生的分析、理解能力及化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 加热蒸干MgCl2饱和溶液,可制得氯化镁固体 | |
| B. | 明矾可用于水的消毒、杀菌 | |
| C. | 使用无磷洗衣粉,可缓解水体富营养化问题 | |
| D. | 用加热法可除去硬水中的CaCl2、MgCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,2.24L 氯气与氢氧化钠溶液完全反应转移的电子数为0.1NA | |
| B. | 标准状况下,1L辛烷完全燃烧后,所生成气体产物的分子数为8NA/22.4 | |
| C. | 0.1L 2mol•L-1的(NH4)2S溶液中含有的S2-数目为0.2 NA | |
| D. | 在含有4mol Si-O键的石英晶体中,氧原子的数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
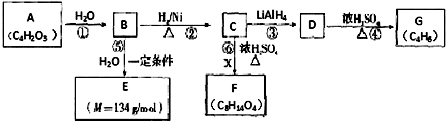
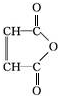 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ③⑥ | C. | ②④ | D. | ③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | Z | |
| ① | NaOH溶液 | Al(OH)3 | 稀硫酸 |
| ② | KOH溶液 | SiO2 | 浓盐酸 |
| ③ | O2 | N2 | H2 |
| ④ | FeCl3溶液 | Cu | 浓硝酸 |
| A. | ①③ | B. | ①④ | C. | ②④ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
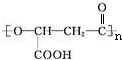
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
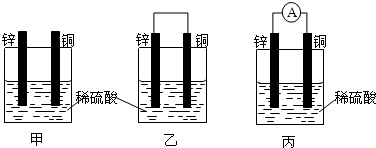
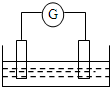 如图是常见原电池装置,电流表G发生偏转:
如图是常见原电池装置,电流表G发生偏转:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com