
【题目】I.下列物质:①N2 ②CO2 ③NH3 ④Na2O ⑤Na2O2 ⑥NaOH ⑦CaBr2 ⑧H2O2 ⑨NH4Cl ⑩HBr。
I.含有极性键和非极性键的是___________________;含有非极性键的离子化合物是____________。(均填序号)
II.下表为元素周期表的一部分,请参照元素①一⑨在表中的位置,用化学用语回答下列问题:
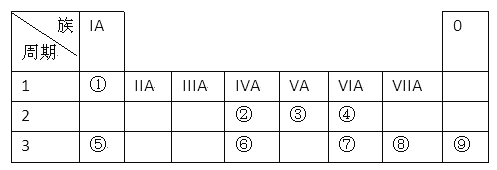
(1)在①~⑨元素中,金属性最强的元素是_____________,化学性质最稳定的元素是________________。(均填元素符号)
(2)元素⑦与元素⑧相比,⑧的非金属性较强,下列表述中能证明这一事实的是____________。
a.常温下⑦的单质和⑧的单质状态不同
b.⑧的氢化物比⑦的氢化物稳定
c.一定条件下⑦和⑧的单质都能与氢氧化钠溶液反应
d.⑦的氧化物的水化物比⑧的氧化物的水化物酸性弱
请设计一个实验,证明元素②与元素⑥的非金属性强弱,只写出反应的化学方程式(不写实验步骤)_____________________________________________________。
(3)⑧构成的单质通入一定浓度的苛性钾溶液中,两者恰好完全反应(该反应为放热反应),生成物中三种含Y 元素的离子,其中两种离子物质的量(n) 与反应时间(t) 的变化如图所示,写出该反应的离子方程式是_______________________________________________。

【答案】 ⑧ ⑤ Na Ar b Na2SiO3+CO2+H2O=Na2CO3+H2SiO3或Na2SiO3+2CO2+2H2O=2NaHCO3+H2SiO3↓ 5Cl2+10OH-=2C1O-+C1O3-+7Cl-+5H2O
【解析】I.①N2中只含非极性键,属于单质;②![]() 、③
、③![]() 、⑩HBr中只含极性键,属于共价化合物;⑧
、⑩HBr中只含极性键,属于共价化合物;⑧![]() 含有
含有![]() 极性键和
极性键和![]() 非极性键,属于共价化合物;⑤
非极性键,属于共价化合物;⑤![]() 中含有离子键和非极性键,属于离子键化合物;⑥NaOH、⑨
中含有离子键和非极性键,属于离子键化合物;⑥NaOH、⑨![]() 中含有离子键和极性键,属于离子键化合物;⑦
中含有离子键和极性键,属于离子键化合物;⑦![]() 、④
、④![]() 中只含离子键,属于离子化合物;含有极性键和非极性键的是⑧;含有非极性键的离子化合物是⑤;正确答案:⑧;⑤。
中只含离子键,属于离子化合物;含有极性键和非极性键的是⑧;含有非极性键的离子化合物是⑤;正确答案:⑧;⑤。
II.由元素在周期表中位置可以知道(1)为H、(2)为C、(3)为N、(4)为O、(5)为Na、(6)为Si、(7)为S、(8)为Cl、(9)为Ar。
(1)在①~⑨元素中,金属性最强的元素是Na;化学性质最稳定的元素是Ar;正确答案:Na; Ar。
(2)a.单质状态属于物理性质,不能比较非金属性强弱,a错误;![]() 的氢化物比(7)的氢化物稳定,说明(8)的非金属性更强,b正确; c.单质与氢氧化钠溶液反应不能比较非金属性强弱,c错误;d.不是最高氧化物对应水化物的酸性强弱比较,不能说明元素非金属性强弱,d错误;证明元素C与元素Si的非金属性强弱,可以用碳酸的酸性大于硅酸的酸性进行比较,把二氧化碳通入硅酸钠溶液中产生白色沉淀,方程式为Na2SiO3+CO2+H2O=Na2CO3+H2SiO3或Na2SiO3+2CO2+2H2O=2NaHCO3+H2SiO3↓;正确选项:b ;Na2SiO3+CO2+H2O=Na2CO3+H2SiO3或Na2SiO3+2CO2+2H2O=2NaHCO3+H2SiO3↓。
的氢化物比(7)的氢化物稳定,说明(8)的非金属性更强,b正确; c.单质与氢氧化钠溶液反应不能比较非金属性强弱,c错误;d.不是最高氧化物对应水化物的酸性强弱比较,不能说明元素非金属性强弱,d错误;证明元素C与元素Si的非金属性强弱,可以用碳酸的酸性大于硅酸的酸性进行比较,把二氧化碳通入硅酸钠溶液中产生白色沉淀,方程式为Na2SiO3+CO2+H2O=Na2CO3+H2SiO3或Na2SiO3+2CO2+2H2O=2NaHCO3+H2SiO3↓;正确选项:b ;Na2SiO3+CO2+H2O=Na2CO3+H2SiO3或Na2SiO3+2CO2+2H2O=2NaHCO3+H2SiO3↓。
(3)由题意可知三种含Y元素的离子为Cl-,ClO-,![]() ;根据图像可以看出n(ClO-)=0.06mol,n(
;根据图像可以看出n(ClO-)=0.06mol,n(![]() )=0.03 mol,根据电子守恒可知:0.06×1+0.03×5=n(Cl-)×1,所以n(Cl-)=0.21 mol,所以n(Cl-):n(ClO-):n(
)=0.03 mol,根据电子守恒可知:0.06×1+0.03×5=n(Cl-)×1,所以n(Cl-)=0.21 mol,所以n(Cl-):n(ClO-):n(![]() )=0.21:0.06:0.03=7:2:1,所以该反应的离子方程式为5Cl2+10OH-=2C1O-+C1O3-+7Cl-+5H2O;正确答案:5Cl2+10OH-=2C1O-+C1O3-+7Cl-+5H2O。
)=0.21:0.06:0.03=7:2:1,所以该反应的离子方程式为5Cl2+10OH-=2C1O-+C1O3-+7Cl-+5H2O;正确答案:5Cl2+10OH-=2C1O-+C1O3-+7Cl-+5H2O。


科目:高中化学 来源: 题型:
【题目】在盛有碘水的试管里加入少量四氯化碳,振荡后静置,可观察到
A. 分层,上层呈紫红色,下层颜色变浅
B. 分层,上层颜色变浅,下层呈紫红色
C. 不分层,液体呈紫红色
D. 不分层,液体为无色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】净水剂能够改善水质,给人们的生活、健康带来很大的益处。
(1) 明矾[KAl(SO4)2·12H2O]是常见的净水剂。其在水中的电离方程式为_______;明矾可净水是因为在天然水中生成胶状Al(OH)3,Al(OH)3具有____的作用。
(2)碱式氯化铝(简称BAC)是高效净水剂的主要成分。实验室模拟利用铝土矿(主要含Al2O3,还含少量Fe2O3及其他不溶杂质)制取碱式氯化铝[Al2(OH)nCl6-n]的过程如下:

①盐酸溶解铝土矿过程中,发生反应的离子方程式为_____________、_______;溶解过程中需不断搅拌,目的是________________。
②加适量铝粉的主要作用是_______________。
③蒸发浓缩所需玻璃仪器为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色工业废水中可能含有Na+、Mg2+、Al3+、Cl-、SO42-中的几种离子。
a.取少许该废水于试管中,加入足量的Ba(NO3)2溶液和稀硝酸,产生白色沉淀,充分反应后过滤,向滤液中加入AgNO3溶液无沉淀产生。
b.另取10mL该废水于试管中,滴加NaOH溶液先产生白色沉淀,后部分沉淀溶解。生成沉淀的物质的量随加入NaOH的物质的量关系如下图所示。
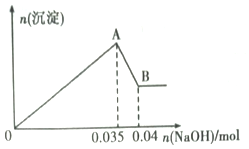
根据上述实验和图中数据:
(1)该废水中一定不含有的离子有______________________________(填离子符号);
(2)写出A→B过程中发生反应的离子方程式:________________________;
(3)该废水中,c(Al3+)=______________;
(4)①实验室配制100mL2mol/L的NaOH溶液时,用到的玻璃仪器除烧杯、玻璃棒、量筒外,还需要_________(填仪器名称)。
②下列操作使所配溶液浓度偏大的是(填写字母)_________。
A.称量用了生锈的砝码
B.将NaOH放在纸张上称量
C.NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中
D.往容量瓶转移时,有少量液体贱出
E.未洗涤溶解NaOH的烧杯
F.定容时仰视刻度线
G.容量瓶未干燥即用来配制溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是部分短周期元素的原子半径及主要化合价,以下叙述正确的是
元素代号 | L | M | Q . | R | T |
原子半径 | 0.160 nm | 0.143 nm | 0.089 nm | 0.102 nm | 0.074 um |
主要化合价 | +2 | + 3 | + 2 | + 6,-2 | -2 |
A. 气态氢化物的稳定性为H2T<H2R
B. 碱性Q(OH)2>L(OH)2
C. M与T形成的化合物可以用作防火材料
D. L2+与R2-的核外电子数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知298K时,某碱MOH的电离平衡常数Kb=1.0×10-5;电离度a=![]() 。在20.00mL0.1000mol/LMOH溶液中滴加0.10mol/L盐酸,测得溶液的pH、温度与所加盐酸的体积的关系如图所示。下列说法不正确的是
。在20.00mL0.1000mol/LMOH溶液中滴加0.10mol/L盐酸,测得溶液的pH、温度与所加盐酸的体积的关系如图所示。下列说法不正确的是

A. a点对应的溶液中:c(OH-)=(M+)+<(H+)
B. b点对应的V。=20.00mL
C. 298K时,0.1000mol/LMOH溶液中,MOH的电离度a=1%
D. 298K时,将0.1molMOH和0.1moMCl溶于水配制成1L混合溶液,溶液的pH>9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F、G是核电荷数依次增大的短周期主族元素。元素A的原子半径是所有元素中最小的。A、D同主族,B、C同周期,C、F最外层电子数相等,F的质子数为C的2倍,元素B的最高价氧化物甲为常见温室气体。B、C、F的质子数之和等于E、G的质子数之和。
(1)写出以上元素的名称:A___________D____________G____________
(2)C、F的氢化物中,沸点较高的是_______(填化学式),原因是_______________________________。
(3)用电子式表示化合物甲的形成过程:___________________________________________________。
(4)少量甲通入由C、D、E三种元素组成的化合物乙的溶液中的离子方程式是:_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱金属元素包括锂、钠、钾、铷、铯、钫等元素,位于元素周期表中第ⅠA族。
(1)画出下列碱金属元素的原子结构示意图:
①锂____________;②钠__________;③钾__________;④铷__________。
(2)比较碱金属元素的原子结构:
①它们在结构上的相同点是___________________________________________________;
②它们在结构上的不同点是___________________________________________________。
(3)碱金属元素原子结构的变化规律是________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列烃①C4H8 ②C4H10 ③C6H12 ④C7H8分别完全燃烧,耗氧量分析正确的是
A. 等质量时耗氧量最多的是④
B. 等物质的量时耗氧量最少的是②
C. 等物质的量时③和④耗氧量相等
D. 某气态烃CxHy与足量O2恰好完全反应,如果反应前后气体体积不变(温度>100℃),则y=4;若体积减小,则y>4;反之,则y<4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com