
【题目】用离子方程式解释以下指定反应,书写正确的是( )
A. 亚硫酸钠溶液显碱性:SO32-+2H2O=H2SO3+2OH-
B. (NH4)2FeSO4溶液与过量NaOH溶液混合制取氢氧化亚铁:Fe2++2OH-=Fe(OH)2
C. NaAlO2溶液中通入过量CO2制取氢氧化铝:2AlO2-+CO2+3H2O=2Al(OH)3+CO32-
D. 铁红溶于HI酸溶液:Fe2O3+6H++2I-=2Fe2++I2+3H2O
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】铬是一种银白色的金属,化学性质稳定,用途广泛。 工业上以铬铁矿[主要成分是 Fe(CrO2)2]为原料冶炼铬及获得强氧化性 Na2Cr2O7,其工艺流程如下图所示:
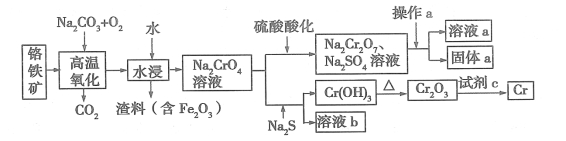
 (1)Na2Cr2O7 中铬元素的化合价为 ,已知 Cr(OH)3 为两性氢氧化物,写出其电离方程式 。
(1)Na2Cr2O7 中铬元素的化合价为 ,已知 Cr(OH)3 为两性氢氧化物,写出其电离方程式 。
(2)写出利用铝热反应制取铬的化学方程式: ,试剂 c 通常还可以是 (至少写两种) 。
(3)酸化过程中,不选用盐酸的原因是 。
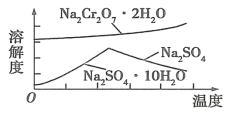
(4)固体 a 的主要成分是 Na2SO4·10H2O,根据图分析,操作a为 、 、过滤。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物有重要用途,如聚合硫酸铁![]() 是一种新型高效的水处理混凝剂,而高铁酸钾(其中铁的化合价为+6)是一种重要的杀菌消毒剂,某课题小组设计如下方案制备上述两种产品:
是一种新型高效的水处理混凝剂,而高铁酸钾(其中铁的化合价为+6)是一种重要的杀菌消毒剂,某课题小组设计如下方案制备上述两种产品:

请回答下列问题:
(1)若A为H2O(g),写出反应方程式:_________________________。
(2)若B为NaClO3与稀硫酸,写出其氧化Fe2+的离子方程式(还原产物为Cl-) 。
(3)若C为KNO3和KOH的混合物,写出其与Fe2O3加热共融制得高铁酸钾(K2FeO4)的化学方程式,并配平:
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,盐酸与氨水混合,所得溶液pH=7,则此溶液中( )
A.c(NH4+)<c(Cl-) B.c(NH4+)=c(Cl-)
C.c(NH4+)>c(Cl-) D.无法确定c(NH4+)与c(Cl-)的关系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关下列图像的分析正确的是
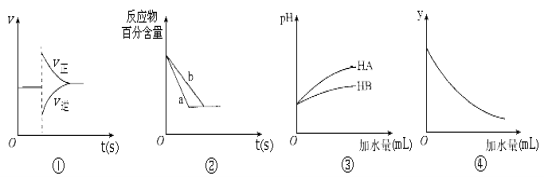
A.图①表示在N2(g)+3H2(g)![]() 2NH3(g)达到平衡后,减少NH3浓度时速率的变化
2NH3(g)达到平衡后,减少NH3浓度时速率的变化
B.图②中a、b曲线分别表示反应H2(g)十I2(g)![]() 2HI(g)在有催化剂和无催化剂存在下建立平衡的过程。
2HI(g)在有催化剂和无催化剂存在下建立平衡的过程。
C.图③说明HB是比HA更弱的酸
D.图④中的y可表示将冰醋酸加水稀释时溶液导电能力的变化情况
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 反应物分子的每次碰撞都能发生化学反应
B. 活化分子之间的碰撞一定是有效碰撞
C. 能够发生化学反应的碰撞是有效碰撞
D. 增大反应物浓度时,活化分子百分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在2L容器中X、Y、Z三种物质随时间的变化关系曲线如图所示:

(1)由图中的数据分析,该反应的化学方程式为________________。
(2)反应开始至2min、5minZ的平均反应速率为_____________、_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验能达到目的的是
A. 用可见光束照射以区别溶液和胶体
B. 将NH4Cl溶液蒸干制备NH4Cl固体
C. 用萃取分液的方法除去酒精中的水
D. 只滴加氨水鉴别NaCl、A1Cl3、MgCl2、Na2SO4四种溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2016年新课标3】下列说法错误的是( )
A.乙烷室温下能与浓盐酸发生取代反应
B.乙烯可以用作生产食品包装材料的原料
C.乙醇室温下在水中的溶解度大于溴乙烷
D.乙酸与甲酸甲酯互为同分异构体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com