
【题目】欲探究某矿石可能是由FeCO3、SiO2、Al2O3中的一种或几种组成,探究过程如图所示.(已知:碳酸不能溶解Al(OH)3沉淀) 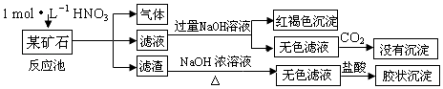
(1)用滤渣制备粗硅的化学反应方程式为
(2)下列说法正确的是
a.酸性:H2CO3>H2SiO3b.结合质子的能力:CO32﹣>AlO2﹣>HCO3﹣
c.稳定性:H2O>CH4>SiH4d.离子半径:O2﹣<Al3+
(3)滤渣和NaOH溶液反应的离子方程式是 , 通过现象说明此矿山中不含Al2O3
(4)该矿石和稀HNO3发生氧化还原反应的离子方程式为 .
【答案】
(1)2C+SiO2 ![]() Si+2CO↑
Si+2CO↑
(2)ac
(3)SiO2+2OH﹣=SiO32﹣+H2O;无色溶液中通入CO2无白色沉淀生成
(4)3FeCO3+10H++NO3﹣=3Fe3++3CO2↑+NO↑+5H2O
【解析】解:矿石中加入稀硝酸生成气体、可溶性物质,同时又溶性物质生成,生成气体说明含有FeCO3 , SiO2不溶于稀硝酸,通过实验现象说明含有SiO2 , 向滤渣中加入NaOH溶液得到无色滤液,二氧化硅和NaOH溶液反应生成偏铝酸钠,向偏铝酸钠溶液中加入稀盐酸生成硅酸胶体沉淀;滤液中加入NaOH溶液得到红褐色沉淀说明滤液中含有铁离子,向无色滤液中通入二氧化碳没有沉淀,说明无色滤液中不含偏铝酸钠,则矿石中不含Al2O3 , (1)滤渣为二氧化硅,二氧化硅和C在高温下反应生成Si,反应方程式为2C+SiO2 ![]() Si+2CO↑,
Si+2CO↑,
所以答案是:2C+SiO2 ![]() Si+2CO↑;(2)a.非金属性:C>Si,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,故a正确;
Si+2CO↑;(2)a.非金属性:C>Si,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,故a正确;
b.酸性:H2CO3>HCO3﹣>Al(OH)3 , 对应的酸越强,则酸根离子得到质子的能力越弱,则结合质子能力:AlO2﹣>CO32﹣>HCO3﹣ , 故b错误;
c.非金属性O>C>Si,元素的非金属性越强,对应的氢化物越稳定,故c正确;
d.两种离子核外电子排布相同,核电荷数越大,离子半径越小,则O2﹣>Al3+ , 故d错误;
所以答案是:ac;(3)二氧化硅和NaOH溶液反应生成偏铝酸钠和水,离子方程式为SiO2+2OH﹣=SiO32﹣+H2O;偏铝酸钠溶液能和过量二氧化碳反应生成氢氧化铝沉淀,该流程图中无色溶液中通入二氧化碳没有白色沉淀生成,说明不含氧化铝,
所以答案是:SiO2+2OH﹣=SiO32﹣+H2O; 无色溶液中通入CO2无白色沉淀生成;(4)该矿石和稀HNO3发生氧化还原反应为碳酸亚铁和硝酸的反应,生成铁离子、二氧化碳、NO和水,反应方程式为3FeCO3+10H++NO3﹣=3Fe3++3CO2↑+NO↑+5H2O,所以答案是:3FeCO3+10H++NO3﹣=3Fe3++3CO2↑+NO↑+5H2O.


 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】下列各组数据中,前者刚好是后者两倍的是( )
A.2 mol H2O的摩尔质量和1 mol H2O的摩尔质量
B.200 mL 1 mol·L1氯化钙溶液中c(Cl)和100 mL 2 mol·L1氯化钾溶液中c(Cl)
C.常温下64 g二氧化硫中氧原子数和标准状况下22.4 L一氧化碳中氧原子数
D.20%NaOH溶液中NaOH的物质的量浓度和10%NaOH溶液中NaOH的物质的量浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是 ( )
A.1 mol H2O的质量为18g/mol
B.CH4的摩尔质量为16g
C.3.01×1023个SO2分子的质量为32g
D.标准状况下,1 mol任何物质体积均为22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于化学反应与能量的下列说法不正确的是
A. 化学反应伴随能量变化B. 光合作用实现能量转化
C. 铝和盐酸反应为放热反应D. 能量降低的反应为吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答以下问题:
(1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是 .
(2)另称取已去除表面氧化物的铁钉(碳素钢)6.0g放入15.0mL浓硫酸中,加热,充分反应后得到溶液X并收集到气体Y.
①甲同学认为X中除Fe3+外还可能含有Fe2+ . 写出生成Fe2+所有可能的离子方程式: . (写出一个即可)
②乙同学取336mL(标准状况)气体Y通入足量氯水中,发生反应的化学方程式为: .
然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33g.由于此推知气体Y中SO2的体积分数为 .
(3)向100mL水中投入Na和Al共16克,充分反应后剩余金属1g.计算放出H2的体积为升(标准状况下)
(4)向一定量的Fe、Fe2O3和CuO混合物投入100mL 2.2mol/L的硫酸溶液中,充分反应后生成896mL标准状况下的气体,得不溶物1.28g,过滤后,向滤液中加入2mol/L的NaOH溶液,加至40mL时开始出现沉淀,则滤液中FeSO4的物质的量浓度为(设滤液体积为100mL)mol/L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X,Y,Z是三种短周期的主族元素,在周期表的位置如图,X原子的最外层电子数是其次外层电子数的3倍,下列说法正确的是( ) 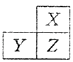
A.原子半径:Y>Z>X
B.气态氢化物的热稳定性:X<Z
C.y和z的最高价氧化物对应水化物均为强酸
D.若z的最高正价为+m,则X的最高正价也一定为+m
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
(1)在一定温度和压强下,1体积X2(g)和3体积Y2(g)化合生成2体积Z(g),则Z气体的化学式是。
(2)A、B两种气体组成的混合气体8.6 g,在标准状况下体积为8.96 L。已知A与B的物质的量之比为3∶1,相对分子质量之比为14∶1,由此可推断A可能是 , B可能是。
(3)在标准状况下,CO和CO2的混合气体质量为36 g,体积为22.4 L,则CO所占的体积是L,质量是 g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知RxO ![]() +MnO
+MnO ![]() +H+―→RO2+Mn2++H2O变化过程中,0.2 mol RxO
+H+―→RO2+Mn2++H2O变化过程中,0.2 mol RxO ![]() 参加反应,共转移0.4 mol 电子。
参加反应,共转移0.4 mol 电子。
(1)反应的氧化产物为。
(2)x=。
(3)参加反应的氢离子的物质的量为。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:
①CaCO3(s)═CaO+CO2(g)△H=+177.7kJ
②C(s)+H2O(s)═CO(g)+H2(g)△H=﹣131.3kJmol﹣1
③ ![]() H2SO4(1)+NaOH(1)═
H2SO4(1)+NaOH(1)═ ![]() Na2SO4(1)+H2O(1)△H=﹣57.3kJmol﹣1
Na2SO4(1)+H2O(1)△H=﹣57.3kJmol﹣1
④C(s)+O2(g)═CO2(g)△H=﹣393.5kJmol﹣1
⑤CO(g)+ ![]() O2(g)═CO2(g)△H=﹣283kJmol﹣1
O2(g)═CO2(g)△H=﹣283kJmol﹣1
⑥HNO3(aq)+NaOH(aq)═NaNO3(aq)+H2O(1)△H=﹣57.3kJmol﹣1
⑦2H2(g)+O2(g)═2H2O(1)△H=﹣517.6kJmol﹣1
(1)上述热化学方程式中,不正确的有 , 不正确的理由分别是 .
(2)根据上述信息,写出C转化为CO的热化学方程式: .
(3)上述反应中,表示燃烧热的热化学方程式有;表示中和热的热化学方程式有
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com