
| A. | b-a=n+m | B. | a-b=n-m | C. | 质子数Y>X | D. | 核电荷数Y<X |
科目:高中化学 来源: 题型:选择题
| A. | 原溶液中一定含有Br-、SO42- | |
| B. | 原溶液一定含有Na+,不含Ba2+ | |
| C. | 实验①与上述离子的检验无关,可以省略 | |
| D. | 若要判断原溶液中是否含有Cl-,所需药品有CCl4溶液、Ba(NO3)2溶液和稀HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实际应称Na2CO3质量/g | 应选用容量瓶的规格/mL | 除容量瓶外还需要的其它仪器 |
| 2.7 | 250mL | 天平、烧杯、玻璃棒、胶头滴管、药匙 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

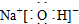 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCO3-、Na+、OH-、K+ | B. | CO32-、Ba2+、K+、NO3- | ||
| C. | Ba2+、OH-、Cl-、Na+ | D. | CO32-、Na+、NO3-、H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯酚溶液、乙醇、己烯、四氯化碳 | B. | 甲酸、乙酸、乙醛、乙醇 | ||
| C. | 淀粉溶液、乙醇、苯、四氯化碳 | D. | 苯、甲苯、己烯、溴苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
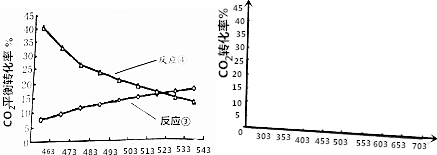
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com