
分析 先根据M=$\frac{m}{n}$求混合气体的平均摩尔质量,根据密度之比等于摩尔质量之比来解答.
解答 解:n(H2)=$\frac{0.2g}{2g/mol}$=0.1mol,n(CO2)=$\frac{8.8g}{44g/mol}$=0.2mol,n(CO)=$\frac{5.6g}{28g/mol}$=0.2mol,混合气体的平均摩尔质量M=$\frac{0.2g+8.8g+5.6g}{0.1mol+0.2mol+0.2mol}$=29.2g/mol,在同温同压下对氢气的相对密度为D=
$\frac{29.2g/mol}{2g/mol}$=14.6,故答案为:14.6.
点评 本题考查物质的量的计算,把握以物质的量为中心的基本计算公式为解答的关键,侧重分析与计算能力的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | Na+、HS-、H+、Cl- | B. | HS-、Na+、OH-、K+ | ||
| C. | K+、CO32-、Br-、AlO2- | D. | H+、Cl-、Na+、SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O与D2O | B. | ${\;}_8^{16}O$与${\;}_8^{18}O$ | ||
| C. | 红磷和白磷 | D. | ${\;}_{6}^{12}$C与C60 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 三种气体质量相等 | B. | 三种气体的物质的量之比为16:2:1 | ||
| C. | 三种气体压强比为16:8:1 | D. | 三种气体体积比为1:8:16 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L 1mol•L-1 K2Cr2O2溶液中Cr2O72-的数目为NA | |
| B. | 1mol C60F60分子中碳原子之间共用电子对数目为90NA | |
| C. | 电解精炼铜时,若阴极得到电子数为2NA,则阳极质量减少64g | |
| D. | 标准状况下,2.24L Cl2完全溶于水,转移电子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质的量是物质粒子的数量的简称 | |
| B. | 摩尔是用来描述物质所含微粒数目多少的基本物理量 | |
| C. | 我们把含有6.02×1023个粒子的任何粒子的集合体计量为1摩尔 | |
| D. | 1mol H2中含2mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
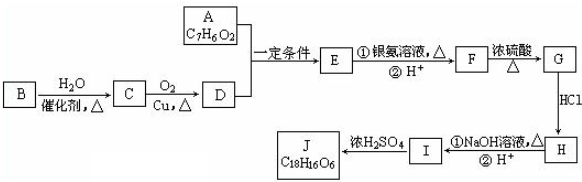

 .
. .
.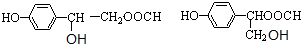 、
、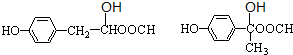 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
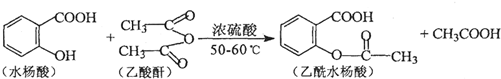
 .
. .
. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com