
分析 由2Fe3++2I-=2Fe2++I2;2Fe2++Br2=2Br-+2Fe3+可知,还原性强弱顺序是:I->Fe2+>Br-,向溶液中通入氯气,氯气先和碘离子反应,然后再和亚铁离子反应,最后再和溴离子反应;根据FeI2、FeBr2、Cl2的物质的量结合反应的离子方程式计算.
解答 解:(1)向含有1mol FeI2和2mol FeBr2的溶液中通入2mol Cl2,先发生反应2I-+Cl2=I2+2Cl-,2mol碘离子完全反应需要氯气1mol,然后发生反应Cl2+2Fe 2+=2Cl-+2Fe3+,1mol氯气反应需要亚铁离子的物质的量是2mol,溶液中含有3mol亚铁离子,参加反应的亚铁离子的物质的量是2mol,所以溶液中还剩余亚铁离子1mol,所以被氧化的离子是2molI-、2molFe 2+,被氧化的I-、Fe 2+的物质的量分别是2mol、2mol;
故答案为:I-、Fe 2+;2mol、2mol;
(2)向原溶液中通入3mol Cl2,先发生反应2I-+Cl2=I2+2Cl-,2mol碘离子完全反应需要氯气1mol,然后发生反应Cl2+2Fe 2+=2Cl-+2Fe3+,3mol亚铁离子反应消耗1.5mol氯气,还剩余0.5mol氯气;
故答案为:3mol;
(3)a mol FeI2完全被氧化转移3amol电子,b mol FeBr2完全被氧化转移3bmol电子,由得失电子守恒可知,当I-、Fe2+、Br-完全被氧化时,消耗氯气为$\frac{1}{2}$×(3a+3b)mol,即c=$\frac{3a+3b}{2}$;
故答案为:$\frac{3a+3b}{2}$.
点评 本题考查氧化还原反应计算,明确还原性的强弱、氧化还原反应的先后顺序是解答本题的关键,侧重分析与计算能力的考查,题目难度中等.


科目:高中化学 来源: 题型:选择题
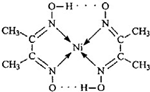 .对该物质的分析判断正确的是( )
.对该物质的分析判断正确的是( )| A. | 该物质是中不存在σ键 | |
| B. | 该物质的分子中只含有共价键、配位键两种作用力 | |
| C. | 该物质是一种配合物,其中N 原子为配位体 | |
| D. | 该物质中C、N、O 原子存在孤对电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S2和S8的混合物共6.4g,其中所含硫原子数一定为0.2NA | |
| B. | 3.4 g NH3中含N-H键数目为0.2NA | |
| C. | 电解精炼铜的过程中,粗铜与电源的负极相连 | |
| D. | CaC2阴阳离子的数目比为1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子序数相差8的两种短周期元素,其周期序数必相差1 | |
| B. | 氢化锂三兄弟-LiH、LiD、LiT三种物质的质子数之比为4:5:6 | |
| C. | 除零族元素外,短周期元素的最高正价在数值上都等于该元素所属的族序数 | |
| D. | 第三周期非金属元素含氧酸的酸性从左到右依次增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X>Y>Z | B. | X>Z>Y | C. | Z>X>Y | D. | Y>Z>X |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 溶液 | A | B | C | D |
| 加入盐酸后的现象 | 无明显变化 | 无明显变化 | 有气泡产生 | 无明显变化 |
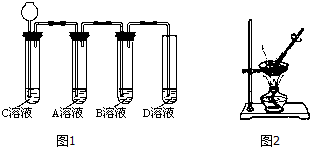
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 已知反应2H2(g)+O2(g)═2H2O(g)的能量变化如图所示,下列说法正确的是( )
已知反应2H2(g)+O2(g)═2H2O(g)的能量变化如图所示,下列说法正确的是( )| A. | 2mol氢气与1mol氧气的总能量为1368kJ | |
| B. | 形成1molH-O键需要吸收463kJ的能量 | |
| C. | 氢气与氧气反应的热化学方程式为2H2+O2═2H2O△H=-484kJ•mol-1 | |
| D. | 1mol氢气与0.5mol氧气反应生成1mol液态水放热大于242kJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com