
能在水溶液中大量共存的一组离子是
A.H+、Fe3+、I-、SO42- B.Al3+、Mg2+、CO32-、Cl-
C.K+、Ag+、Ca2+、NO3- D.NH4+、Na+、OH-、MnO4-
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:
| A、Na2O2、Cl2、SO2依次属于电解质、单质、非电解质 | B、1molNa2O2和水反应,转移电子数目为2mol | C、等物质的量的Cl2和SO2同时通入品红溶液,褪色更快 | D、在Na2O2中阴阳离子所含的电子数目相等 |
查看答案和解析>>
科目:高中化学 来源:2015届广东省揭阳市高三上学期第一次阶段考试理综试卷(解析版) 题型:选择题
下列实验中,依据实验操作及现象,得出的结论正确的是
| 操 作 | 现 象 | 结 论 |
A | 取久置的Na2O2粉末,向其中滴加过量的盐酸 | 产生无色气体 | Na2O2没有变质 |
B | 将一片铝箔置于酒精灯外焰上灼烧 | 铝箔熔化但不滴落 | 铝箔表面有致密Al2O3薄膜,且Al2O3熔点高于Al |
C | 测定等浓度的Na2CO3和Na2SO4 溶液的pH | 前者pH比后者的大 | 非金属性: |
D | 向溶液X中加入稀盐酸,并将产生的无色气体通入澄清石灰水中 | 生成白色沉淀 | 溶液X中一定含有 CO32-或 HCO3- |
查看答案和解析>>
科目:高中化学 来源:2015届广东省惠州市高三第二次调研考试化学试卷(解析版) 题型:选择题
下列装置、试剂选用或操作正确的是
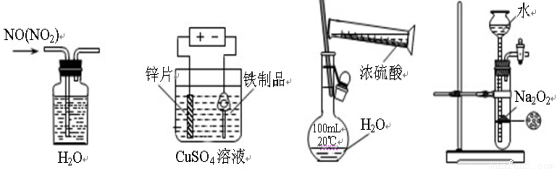
A.除去NO中的NO2 B.铁制品表面镀锌 C.稀释浓硫酸 D.制备少量O2
查看答案和解析>>
科目:高中化学 来源:2015届广东省广州市高三9月第二次月考化学试卷(解析版) 题型:选择题
甲~辛等元素在周期表中的相对位置如下表。
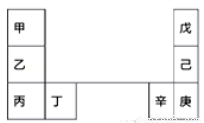
甲和戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁和辛属同周期元素。下列判断不正确的是
A.与水反应的剧烈程度:甲>乙>丁
B.气态氢化物的沸点:戊<己<庚
C.丙和庚的核外电子数相差15
D.乙单质在空气中燃烧生成含共价键的离子化合物
查看答案和解析>>
科目:高中化学 来源:2015届广东省广州市高三上学期期中考试理综化学试卷(解析版) 题型:填空题
(16分)目前世界上已证明“达菲”是治疗禽流感和甲型H1N1流感的良方。“达菲”的主要合成原料是我国盛产的莽草酸。从八角茴香中提取的莽草酸经过多次反应和其他工艺制成“达菲”颗粒。下图是莽草酸和“达菲”有效成分的键线式结构(楔形实线、虚线表示基团的立体结构)。
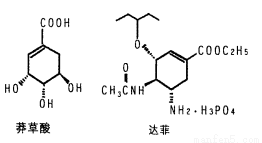
(1)“达菲”的相对分子质量为410.4,扣除H3PO4后的部分称为“自由基奥司他韦”。试求“自由基奥司他韦”的相对分子质量________;“自由基奥司他韦”能与磷酸结合,说明氨基具有________性。
(2)莽草酸中含有的官能团有__________________________(写名称)。
(3)下列有关莽草酸的说法中正确的是____________________________。
①分子式为C7H10O5
②能使FeCl3溶液显紫色
③能使溴的四氯化碳溶液褪色
④l mol莽草酸与分别足量的Na和NaOH反应,消耗的Na和NaOH的物质的量之比为4:l
(4)莽草酸与C2H5OH发生酯化反应的化学方程式是_________________。
(5)莽草酸在浓硫酸作用下加热可得到B(C7H6O3),B的同分异构体中既含有酚羟基又含有酯基的共有______种,写出其中一种同分异构体的结构简式 。
查看答案和解析>>
科目:高中化学 来源:2015届广东省广州市高三上学期期中考试理综化学试卷(解析版) 题型:选择题
NA表示阿伏伽德罗常数,下列判断正确的是
A.在20 g D216O中含有10NA个电子
B.标准状况下,2.24 L己烷所含分子数为0.1NA
C.1 mol Cl2参加反应转移电子数一定为2NA
D.含NA个Na+的Na2O溶解于1 L水中,Na+的物质的量浓度为1 mol/L
查看答案和解析>>
科目:高中化学 来源:2015届广东省佛山市高三10月月考化学试卷(解析版) 题型:填空题
(16分)对金属制品进行抗腐蚀处理,可延长其使用寿命。
(1)以下为铝材表面处理的一种方法:
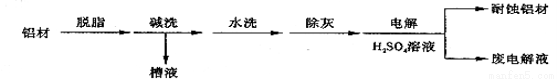
①碱洗的目的是除去铝材表面的自然氧化膜,碱洗时候常有气泡冒出,原因是 (用离子方程式表示)。为将碱洗槽液中的铝以沉淀形式回收,最好向槽液中加入下列试剂中的 。
a.NH3 b.CO2 c.NaOH d.HNO3
②以铝材为阳极,在H2SO4溶液中电解,电解后取少量废电解液,加入NaHCO3,溶液后产生气泡和白色沉淀,产生沉淀的原因是 (用离子方程式表示)
(2)镀铜可防止铁制品腐蚀,电镀时用 来做阳极。
(3)利用如图装置,可以模拟铁的电化学防护。

若X为碳棒,为减缓铁的腐蚀,开关K应放于 处,写出X极的电极反应
若X为碳棒,开关K置于M处,写出X极的电极反应
查看答案和解析>>
科目:高中化学 来源:2015届广东省中山市高三上学期第二次模拟考试化学试卷(解析版) 题型:填空题
(14分)某校化学兴趣小组为研究Cl2单质的性质,设计如下图所示装置进行实验。装置III中夹持装置已略去,其中a为干燥的品红试纸,b为湿润的品红试纸。
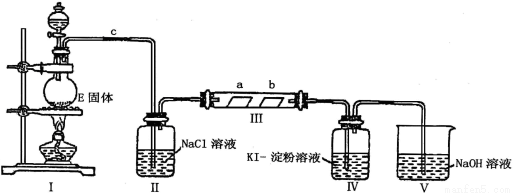
(1)实验室以二氧化锰和浓盐酸制备氯气的化学方程式是 。
(2)加入药品前,检查I中气体发生装置气密性的操作是:____________________。
(3)装置Ⅱ的作用是 。
(4)实验过程中,装置IV中的实验现象为___________________________________;发生反应的化学方程式为 。
(5)实验结束后,该组同学在装置III中观察到b的红色褪去,但是并未观察到“a无明显变化”这一预期现象。为了达到这一实验目的,你认为应在_________之间还需添加洗气瓶(选填装置序号),该装置的作用是______________________。
(6)装置Ⅴ的目的是防止尾气污染空气,写出装置Ⅴ中发生反应的离子方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com