
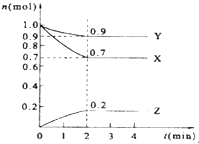
 某温度时,在2L的密闭容器中,X、Y、Z三种气体物质的量随时间的变化曲线如图所示.
某温度时,在2L的密闭容器中,X、Y、Z三种气体物质的量随时间的变化曲线如图所示.分析 (1)从图中可知X的起始量为1.0mol,2分钟达平衡,X转化了0.3mol,再根据公式$\frac{X转化的物质的量}{X起始的物质的量}$×100%计算;
(2)根据物质的量的变化判断反应物和生成物,根据物质的量的变化之比等于化学计量数之比书写方程式;
(3)根据v=$\frac{△c}{△t}$计算反应速率;
(4)各物质的量不再变化,达到平衡;
(5)加快该反应速率的方法有升温、增大浓度、增大压强、使用催化剂等;
(6)在一定条件下,当化学反应达到平衡状态时,正逆反应速率相等,各物质的浓度不变,由此衍生的一些物理量也不变.
解答 解:(1)从图中可知X的起始量为1.0mol,2分钟达平衡,X转化了0.3mol,则X的转化率=$\frac{0.3mol}{1.0mol}$×100%=30%,
故答案为:30%;
(2)由图象可以看出,反应中X、Y的物质的量减小,Z的物质的量增多,则X、Y为反应物,Z为生成物,
且△n(X):△n(Y):△n(Z)=0.3mol:0.1mol:0.2mol=3:1:2,则反应的化学方程式为:3X+Y?2Z,
故答案为:3X+Y?2Z;
(3)v(Z)=$\frac{△c}{△t}$=$\frac{0.2mol}{2L×2min}$=0.05mol•(L•min)-1,
故答案为:0.05mol•(L•min)-1;
(4)2min时,各物质的量不再变化,达到平衡,
故答案为:2;
(5)加快该反应速率的方法有升温、增大反应物的浓度、增大压强、使用催化剂等,
a.向该容器中充入一定量的z气体,容器体积不变,增大了生成物浓度,逆反应速率加快,正反应速率随之也会加快,故a正确;
b.向该容器中充去一定量的He气,容器体积不变,各物质的浓度不变,对反应速率无影响,故b错误;
c.升高反应的温度,速率加快,故c正确;
d.降低反应的温度,速率减慢,故d错误;
e.分离出生成的z气体,生成物浓度减小,逆反应速率减小,正反应速率随之也会减小,故e错误;
故答案为:ac;
(6)在一定条件下,当化学反应达到平衡状态时,正逆反应速率相等,各物质的浓度不变,由此衍生的一些物理量也不变,
a.达平衡时是各物质浓度保持不变,不是成比例,三种气体的浓度之比为3:1:2时不一定达到平衡,故a错误;
b.n(Z)的量不再改变,物质的量不再变化说明已达平衡,故b正确;
c.从方程式可知这是一个气体总物质的量在减小的反应,当气体的总物质的量不变时,说明各物质的量不变,达到平衡,故c正确;
d.容器的体积不变,根据质量守恒,气体的总质量也不变,气体的密度始终不变,不能说明达到平衡,故d错误;
e.生成3mol X的方向是逆方向,生成了2mol的Z的方向是正方向,方向相反,且X与Z的变化量之比等于其计量数之比,说明正反应速率与逆反应速率相等,则达到平衡,故e正确;
故答案为:bce.
点评 本题考查化学平衡图象分析题目,注意分析各物质的量的变化曲线,注意化学方程式的判断方法,理解影响化学反应速率的因素和化学平衡状态的判断,题目难度适中.


 全能测控一本好卷系列答案
全能测控一本好卷系列答案 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ③ | |||||
| 三 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 四 | ⑨ | ⑩ |
 .
. ,该化合物属于离子(填“共价”或“离子”)化合物.
,该化合物属于离子(填“共价”或“离子”)化合物.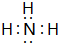 ,该化合物是由极性(填“极性”或“非极性”)键形成的.
,该化合物是由极性(填“极性”或“非极性”)键形成的.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原电池中,负极上发生的反应是还原反应 | |
| B. | 原电池中,电流的方向是负极-导线-正极 | |
| C. | 双液原电池中的盐桥是为了联通电路,所以也可以用金属导线代替 | |
| D. | 在原电池中,阳离子移向正极,阴离子移向负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
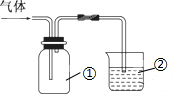
| 选项 | 气体 | 试剂 | 现象 | 结论 |
| A | X(能形成酸雨) | KI淀粉溶液 | 溶液变蓝 | X是NO2 |
| B | NH3 | 酚酞溶液 | 溶液变红色 | NH3的水溶液显碱性 |
| C | Cl2 | 紫色石蕊试液 | 溶液立即褪色 | Cl2有氧化性 |
| D | SO2 | 溴水 | 溶液褪色 | SO2有漂白性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NX2一定不与酸反应 | |
| B. | R2与水反应时,水是还原剂 | |
| C. | 简单离子的半径:M<Z<X | |
| D. | 最高价氧化物对应水化物的碱性:Z<M |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com