
| A. | x=2 | |
| B. | Fe2+、S2O32-都是还原剂 | |
| C. | 硫元素被氧化,铁元素被还原 | |
| D. | 每生成1 mol Fe2O4,则转移电子数为3 mol |
分析 在3Fe2++2S2O32-+O2+XOH-=Fe3O4+S4O62-+2H2O中,化合物中铁元素、硫元素用平均化合价,铁元素的化合价变化:+2→+$\frac{8}{3}$;硫元素的化合价变化为:+2→+$\frac{5}{2}$;氧元素的化合价变化:0→-2,所以氧化剂是O2;还原剂是Fe2+、S2O32-,结合离子方程式的电荷守恒原则判断x,根据化合价的变化计算转移的电子数目.
解答 解:A.由电荷守恒可知:2×3+2×(-2)-X=-2,X=4,故A错误;
B.由上述分析可知,还原剂是Fe2+、S2O32-,氧化剂是O2,故B正确;
C.化合物中铁元素、硫元素用平均化合价,铁元素的化合价变化:+2→+$\frac{8}{3}$;硫元素的化合价变化为:+2→+$\frac{5}{2}$,Fe和S元素都被氧化,故C错误;
D.由方程式可知,每生成1molFe3O4,参加反应的氧气为1mol,转移电子数为1mol×4=4mol,故D错误.
故选B.
点评 本题考查氧化还原反应的基本概念与计算,Fe3O4是复杂的化合物,铁元素既有+2价也有+3价,把Fe3O4中铁元素的化合价用平均化合价处理,S2O32-的硫元素的化合价用平均化合价处理是解本题的关键,本题难度较大,需细心分析.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
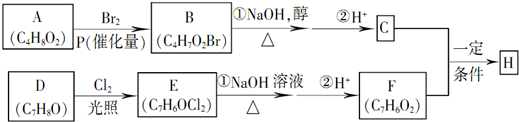
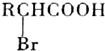
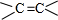 ;
;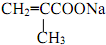 +NaBr+2H2O,该反应的类型为消去反应;
+NaBr+2H2O,该反应的类型为消去反应; $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$ +H2O.
+H2O.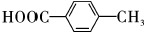 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 1 mol FeBr2与足量氯气反应时,理论上转移的电子数约为3×6.02×1023 | |
| B. | 常温下,pH均为3的三种溶液:①HCl溶液 ②H2SO4溶液③CH3COOH溶液,各自溶质的物质的量浓度大小顺序为①=②<③ | |
| C. | 电解熔融NaCl或AlCl3制取Na或Al | |
| D. | 一定条件下反应Cr2O72-(aq)+H2O(l)?2CrO42-(aq)+2H+(aq)达到平衡后,滴加少量浓硫酸,重新达平衡前,2v正(Cr2O72-)<v逆(CrO42-) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | H2SO4是酸,因为H2SO4中含有氢元素 | |
| B. | 豆浆是胶体,因为豆浆中的分散质粒子直径在1~100 nm之间 | |
| C. | Na在Cl2中燃烧属于氧化还原反应,因为反应中有电子得失 | |
| D. | Na和H2O的反应不是离子反应,因为反应中没有离子参加 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | -109kJ•mol-1 | B. | -218kJ•mol-1 | C. | +109kJ•mol-1 | D. | +218kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应①、②均为氧化还原反应 | |
| B. | 反应①中氧化产物与还原产物的物质的量之比为1:1 | |
| C. | 上述尾气N0x的吸收过程中.共转移电子的物质的量为1mol | |
| D. | 上述尾气中NO2与N0的体积比为6:1. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
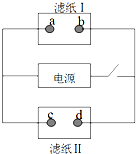 如图中滤纸Ⅰ上浸有饱和食盐水和酚酞,滤纸Ⅱ上浸有KMnO4溶液,接通电源一段时间后,发现a点附近变红,则下列说法中正确的是( )
如图中滤纸Ⅰ上浸有饱和食盐水和酚酞,滤纸Ⅱ上浸有KMnO4溶液,接通电源一段时间后,发现a点附近变红,则下列说法中正确的是( )| A. | a点和电源正极相连 | B. | b点发生还原反应 | ||
| C. | c点附近pH减小 | D. | d点附近颜色加深 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定条件下,Cl2可在甲苯的苯环或侧链上发生取代反应 | |
| B. | 苯能使溴水褪色,是因为苯与溴发生了化学反应 | |
| C. | 乙烷和丙烯的物质的量共1mol,完全燃烧生成3 mol H2O | |
| D. | 光照下2,2二甲基丙烷与Br2反应,其一溴取代物只有一种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com