
| A. | 制备AlCl3晶体:将AlCl3溶液加热、蒸干,并灼烧 | |
| B. | 证明某卤代烃中的碘原子:在卤代烃中滴加NaOH溶液,振荡后滴加AgNO3溶液 | |
| C. | 鉴别乙醇、乙醛、乙酸三种物质的水溶液:用新制碱性氢氧化铜悬浊液 | |
| D. | 检验甲酸中混有甲醛:可先向样品中加入足量NaOH溶液中和甲酸,再进行银镜反应实验 |
分析 A.氯化铝是强酸弱碱盐,铝离子水解生成HCl,生成的HCl水溶液以挥发,升高温度促进其挥发,所以蒸干溶液得到氢氧化铝固体,灼烧氢氧化铝固体分解生成氧化铝;
B.加入硝酸银溶液前需要用稀硝酸中和NaOH,否则氢氧根离子与银离子反应,干扰了检验结果;
C.加入新制Cu(OH)2悬浊液,乙醇不反应,乙醛在加热时生成砖红色沉淀,乙酸和氢氧化铜发生中和反应;
D.甲酸钠和甲醛中都含有醛基,都能发生银镜反应.
解答 解:A.AlCl3在加热时水解生成Al(OH)3和HCl,HCl易挥发,蒸干灼烧得到的是Al2O3,无法获得AlCl3晶体,故A错误;
B.证明某卤代烃中的碘原子:在卤代烃中滴加NaOH溶液加热,冷却后加入稀硝酸中和氢氧化钠,振荡后再滴加AgNO3溶液,否则氢氧根离子与银离子反应,干扰了卤素离子的检验,故B错误;
C.加入新制Cu(OH)2悬浊液,乙醇不反应,乙醛在加热时生成砖红色沉淀,乙酸和氢氧化铜发生中和反应,氢氧化铜溶解,现象不同,所以可以鉴别,故C正确;
D.甲酸钠和甲醛中都含有醛基,都能发生银镜反应,所以用足量氢氧化钠溶液和银氨溶液不能鉴别二者,故D错误;
故选C.
点评 本题考查了实验方案评价,明确实验原理是解本题关键,根据物质的性质来分析解答,注意掌握卤代烃中卤元素的检验方法、物质的检验等知识点,易错选项是B,检验卤代烃中的卤元素时要注意水解后先中和碱,为易错点.


 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 碳酸钙溶于醋酸:CaCO3+2H+=Ca2++CO2↑+H2O | |
| B. | 用烧碱溶液吸收氯气:Cl2+2OH-=Cl-+ClO-+H2O | |
| C. | NH4HSO4溶液与过量NaOH稀溶液反应:NH4++OH-=NH3•H2O | |
| D. | FeBr2溶液中通入少量Cl2:2Fe2++2Br-+Cl2=2Fe3++Br2+2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ④⑤①②③ | B. | ④⑤③②① | C. | ①②③④⑤ | D. | ②①③⑤④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.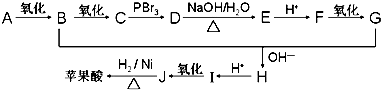


 +n HO-CH2CH2-OH$\stackrel{一定条件}{→}$
+n HO-CH2CH2-OH$\stackrel{一定条件}{→}$ +(2n-1)H2O
+(2n-1)H2O 、
、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质量为14g | B. | 分子数为6.02×1023 | ||
| C. | 体积为11.2L | D. | 物质的量为2mol |
查看答案和解析>>
科目:高中化学 来源:2017届宁夏高三上第二次适应性考试化学卷(解析版) 题型:填空题
某反应体系的物质有:NaOH、Au2O3、Na2S4O6、Na2S2O3、Au2O、H2O。
(1)请将Au2O3之外反应物与生成物分别填入以下空格内。
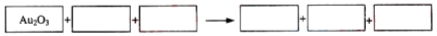
(2)反应中,被还原的元素是____________,还原剂是____________。
(3)将氧化剂与还原剂填入空格中,并标出电子转移的方向和数目。

(4)纺织工业中常用氯气作漂白剂,Na2S2O3可作为漂白后布匹“脱氯剂”,Na2S2O3和Cl2反应的产物是H2SO4、NaCl和HCl,则还原剂 与氧化剂物质的量之比为__________。
与氧化剂物质的量之比为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com