
| A. | 存在 2,2-二甲基-3-戊炔 | |
| B. | 月桂烯分子中( 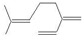 )所有碳原子一定在同一平面上 )所有碳原子一定在同一平面上 | |
| C. | CF2Cl2存在两种同分异构体 | |
| D. | 用红外光谱法可鉴别二甲醚和乙醇 |
分析 A.依据系统命名法分析判断,主链编号起点选错;
B.分子中含2个亚甲基,均为四面体结构;
C.甲烷是正四面体型结构,CF2Cl2是甲烷的取代产物,运用知识迁移的方法,与CH4的分子构型对比,CF2Cl2是烷的取代产物,为四面体结构,因此结构只有一种,没有同分异构体;
D.二甲醚中含C-O-C,而乙醇中含C-O-H;
解答 解:A.2,2-二甲基-3-戊炔名称中主碳链编号起点错误,正确的名称为:4,4-二甲基-2-戊炔,故A错误;
B.分子中含2个亚甲基,均为四面体结构,则所有C原子不一定共面,故B错误;
C.甲烷是空气正四面体结构,碳原子位于正四面体的中心,4个氢原子位于4个顶点上,4个氢原子完全等效,CF2Cl2是甲烷的取代产物,所以CF2Cl2也是空间四面体结构,只有一种结构,故C错误;
D.二甲醚中含C-O-C,而乙醇中含C-O-H,则利用红外光谱法可以鉴别二甲醚和乙醇,故D正确;
故选D.
点评 本题考查了物质结构分析、同分异构体书写、官能团鉴别等知识点,掌握基础是解题关键,题目难度不大.


 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:选择题
| A. | 反应A(g)+B(g)═2C(s)可以自发进行,则其必为放热反应 | |
| B. | 从C(石墨,s)═C(金刚石,s)△H=+1.9 kJ/mol,可知:金刚石比石墨更稳定 | |
| C. | 等质量的硫蒸气和硫固体分别完全燃烧,后者放出热量更多 | |
| D. | 若2H2(g)+O2(g)=2H2O(g)△H=-483.6 kJ•mol-1,则H2燃烧热为241.8 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
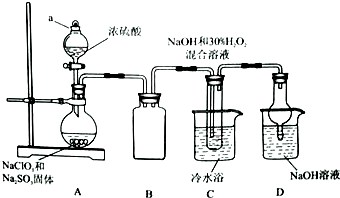 实验室欲制备高效漂白剂亚氯酸钠(NaCLO2),并对其样品进行分析.
实验室欲制备高效漂白剂亚氯酸钠(NaCLO2),并对其样品进行分析.查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4mol | B. | 3mol | C. | 5mol | D. | 2.5mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | L | M | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | -2 |
| A. | L2+与R2-的核外电子数相等 | B. | M与T形成的化合物具有两性 | ||
| C. | 气态氢化物的稳定性为H2T>H2R | D. | L和M金属性强弱比较:L>M |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为减缓金属腐蚀,可将要保护的金属物件与外电源的正极相连接做阴极 | |
| B. | 在pH<5的溶液中,金属主要发生析氢腐蚀 | |
| C. | 钢铁制品吸氧腐蚀时正极反应为:O2+2H2O+4e-=4OH- | |
| D. | 在金属物件表面涂上机油可防止金属生锈从而使金属保持光泽 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

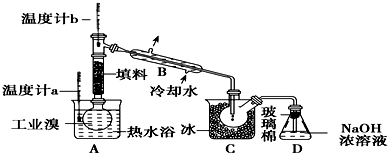
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com