
| 酸 | 碱 | 盐 | 氧化物 | |
| A | 硫 酸 | 纯 碱 | 硫酸钡 | 水 |
| B | 氢硫酸 | 烧 碱 | 纯 碱 | 石灰石 |
| C | 碳 酸 | 熟石灰 | 小苏打 | 二氧化硫 |
| D | 二氧化碳 | 苛性钾 | 食 盐 | 石灰石 |
| A. | A | B. | B | C. | C | D. | D |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 高分子分离膜应用于食品工业中,可用来浓缩天然果汁、乳制品加工、酿造业等 | |
| B. | 复合材料一般是以一种材料做基体,另一种材料作为增强剂 | |
| C. | 合成高分子材料制成的人工器官一般都受到人体的排斥,难以达到生物相容的程度 | |
| D. | 导电塑料是应用于电子工业的一种新型有机高分子材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化物:CuO、NO、SO2、H2O | |
| B. | 碱:NaOH、KOH、Ba(OH)2、Na2CO3 | |
| C. | 碱性氧化物:Na2O、CaO、Al2O3、Na2O2 | |
| D. | 电解质:KNO3、Cl2、HCl、BaSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
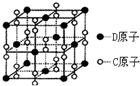 已知A、B、C、D、E都是元素周期表中的前36号元素,它们的原子序数依次增大.B原子基态时P原子轨道上有3个未成对电子,其最高正价与最低负价代数和为2,C的价层电子排布式为ns2npn+2,其氢化物是同族元素所形成的氢化物中沸点最大.化合物AC2为非极性分子,D元素的原子核外共有20种不同运动状态的电子.E是元素周期表第四周期第9列元素.请回答:
已知A、B、C、D、E都是元素周期表中的前36号元素,它们的原子序数依次增大.B原子基态时P原子轨道上有3个未成对电子,其最高正价与最低负价代数和为2,C的价层电子排布式为ns2npn+2,其氢化物是同族元素所形成的氢化物中沸点最大.化合物AC2为非极性分子,D元素的原子核外共有20种不同运动状态的电子.E是元素周期表第四周期第9列元素.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用待测液润洗滴定用的锥形瓶 | |
| B. | 常温下,某同学用pH试纸测得KCl溶液的pH约为7.0 | |
| C. | 配制Fe2(SO4)3溶液时,先把Fe2(SO4)3晶体溶于浓硫酸后稀释 | |
| D. | 用碱式滴定管准确移取KMnO4溶液,体积为21.50mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2mol/LH2SO4溶液 | B. | 2mol/LNaOH溶液 | ||
| C. | 2mol/LMgSO4溶液 | D. | 硅酸溶胶(胶体粒子带负电荷) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定温度和压强下,气态物质的体积主要由构成气体的分子的大小决定 | |
| B. | 从1 L 2 mol/L的H2SO4溶液中取出0.5 L,该溶液中氢离子的浓度为4mol/L | |
| C. | 同温同压下,30mLA2气体和10mL B2气体恰好完全反应生成20mLC气体,则C化学式为 A3 B或B A3 | |
| D. | 同温同压下任何气体的分子间距离几乎相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 相同体积的任何气体都含有相同数目的分子 | |
| B. | 标准状况下,5L H2S气体与5L NH3的原子个数比为3:4. | |
| C. | 同温同压下相同体积的N2气和CO气体有相同物质的量、相同的质量和相同的对空气的密度 | |
| D. | 相同温度下,气体的压强比等于气体体积的反比 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 粒子符号 | 相对分子(原子)质量 | 每个粒子的质量(g/个) | 1mol物质含有的粒子数(个) | 1mol物质质量(g) |
| C | 1.993×10-23 | |||
| Fe | 9.302×10-23 | |||
| H2SO4 | 1.628×10-22 | |||
| H2O | 2.990×10-23 | |||
| Na+ | 3.821×10-23 | |||
| OH- | 2.824×10-23 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com