
【题目】氨基甲酸铵(NH2COONH4)是一种易分解、易水解的白色固体、难溶于CCl4。实验室可将干燥二氧化碳和氨气通入CCl4中进行制备,反应原理为2NH3(g)+CO2(g)=NH2COONH4(s) △H<0,回答下列问题:
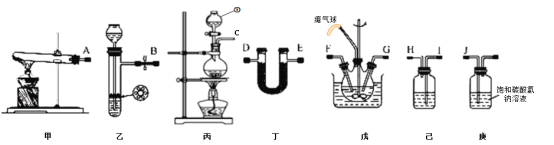
(1)仪器①的名称为_____,装置己中盛放的试剂为_____。
(2)简述检验装置乙气密性的操作_____。
(3)氨气的发生装置可以选择上图中的_____,制取氨气的化学方程式为_____。
(4)预制备产品,选择上图中必要的装置,其连接顺序为:发生装置→_____→FG←_____←KJ←_____(按气流方向,用大写字母表示)。
(5)为了提高氨基甲酸铵的产率.对三颈瓶采取的控温方法是_____,反应结束后,从反应后的混合物中分离出产品的实验操作是_____,戊中气球的作用是_____。
(6)氨基甲酸铵容易变质生成碳酸氢铵,现取长期存放的样品19.550g,用足量石灰水处理后,使样品中碳元素完全转化为碳酸钙,通过系列操作得纯净碳酸钙25.000g,则该样品的纯度为_____%。(计算结果保留三位有效数字;有关物质的相对式量:氨基甲酸铵78、碳酸氢铵79、碳酸钙100) 。
【答案】分液漏斗 浓硫酸 夹紧止水夹,从长颈漏斗加水至漏斗内液面高于试管内液面,静置,若液面保持不变,说明气密性良好 甲或丙 2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O或NH3·H2O
CaCl2+2NH3↑+2H2O或NH3·H2O![]() NH3↑+H2O DE(或ED) HI B 冷水浴 过滤 平衡压强,收集尾气 79.8
NH3↑+H2O DE(或ED) HI B 冷水浴 过滤 平衡压强,收集尾气 79.8
【解析】
用甲或丙制取氨气,用碱石灰干燥后通入CCl4中,用乙装置制取二氧化碳气体,用碳酸氢钠除去二氧化碳中的氯化氢,用浓硫酸干燥后通入CCl4中,在三颈瓶中搅拌发生反应2NH3(g)+CO2(g)=NH2COONH4(s) 。
(1)根据图示,仪器①是分液漏斗,装置己用于干燥二氧化碳,盛放的试剂为浓硫酸;
(2)检验装置乙气密性的操作是:夹紧止水夹,从长颈漏斗加水至漏斗内液面高于试管内液面,静置,若液面保持不变,说明气密性良好;
(3)实验室用加热氯化铵、氢氧化钙固体混合物或加热浓氨水的的方法制取氨气,所以氨气的发生装置可以选择上图中的甲或丙,制取氨气的化学方程式为2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O或NH3·H2O
CaCl2+2NH3↑+2H2O或NH3·H2O![]() NH3↑+H2O;
NH3↑+H2O;
(4) 用甲或丙制取氨气,用碱石灰干燥后通入CCl4中,用乙装置制取二氧化碳气体,用碳酸氢钠除去二氧化碳中的氯化氢,用浓硫酸干燥后通入CCl4中,氨气、二氧化碳在三颈瓶中反应生成氨基甲酸铵,其连接顺序为:发生装置→DE→FG←HI←KJ←B ;
(5)正反应放热,为了提高氨基甲酸铵的产率,对三颈瓶采取的控温方法是冷水浴,氨基甲酸铵难溶于CCl4,反应结束后,从反应后的混合物中分离出产品的实验操作是过滤,戊中气球的作用是平衡压强,收集尾气;
(6) 通过系列操作得纯净碳酸钙25.000g,则样品中碳元素的物质的量为![]() ,设样品中氨基甲酸铵的质量为xg,
,设样品中氨基甲酸铵的质量为xg,![]() ,x=0.2mol,则该样品的纯度为
,x=0.2mol,则该样品的纯度为![]() 79.8%。
79.8%。


科目:高中化学 来源: 题型:
【题目】常温下,用AgNO3溶液分别滴定浓度均为0.01mol/L的KCl、K2C2O4溶液,所得的沉淀溶解平衡图象如图所示(不考虑![]() 的水解,pAg=
的水解,pAg=![]() lgc(Ag+)),下列说法正确的是
lgc(Ag+)),下列说法正确的是

A.KspAg2C2O4的数量级等于10-10
B.n点表示AgCl的过饱和溶液
C.向c(Cl-)=c(![]() )的混合液中滴入AgNO3溶液时,先生成Ag2C2O4沉淀
)的混合液中滴入AgNO3溶液时,先生成Ag2C2O4沉淀
D.Ag2C2O4+2Cl-![]() 2AgCl+
2AgCl+![]() 的平衡常数为103.29
的平衡常数为103.29
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】类比pH的定义,对于稀溶液可以定义pC(X)=-lgc(X),pKa=-lgKa,常温下,某浓度H2A溶液在不同pH下,测得pC(H2A)、pC(HA-)、pC(A2-)变化如图所示,下列说法正确的是
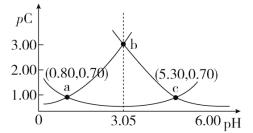
A.随着pH的增大,pC增大的曲线是A2-的物质的量浓度的负对数
B.pH=4.50时,c(HA-)>c(A2-)=c(H2A)
C.b点时,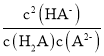 =104.50
=104.50
D.pH=3.00~5.30时,c(H2A)+c(HA-)+c(A2-)先减小后增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁粉和氧化亚铁粉末的混合物共9.2克,加入到150毫升的稀硫酸中,恰好完全反应,得到氢气2.24升(标准状况)。求:
(1)混合物中铁的质量?___
(2)原稀硫酸的物质的量浓度?___
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙基叔丁基酸(以ETBE表示)是一种性能优良的高辛烷值汽油调和剂,用乙醇与异丁烯(以IB表示)在催化剂HZSM-5催化下合成ETBE,反应的化学方程式为:C2H5OH(g)+IB(g)![]() ETBE(g) △H,回答下列问题:
ETBE(g) △H,回答下列问题:

注:C1表示乙醇和异丁烯同时吸附,C2表示先吸附乙醇,C3表示先吸附异丁烯。
(1)反应物被催化剂HZSM-5吸附的顺序与反应历程的关系如上图所示,该反应的△H=____akJ·mol-1,下列选项正确的是______(填序号)。
A.反应历程的最优途径是C1
B.HZSM-5没有参加化学反应
C.相同条件下,采用不同途径时,乙醇的平衡转化率C1>C2>C3
D.升高反应温度有利于提高平衡产率
(2)向刚性容器中按物质的量之比1:1充入乙醇和异丁烯,在温度为378 K与388 K时异丁烯的转化率随时间变化如图所示。

①图中A、M、B三点,化学反应速率由大到小的顺序为______,其中逆反应速率最大的点是______(用符号A、M、B填写)。
②388 K时,容器内起始总压为P0 Pa,用分压表示的该反应的平衡常数K=______Pa-1(用含有P0的式子表示)。
③瑞典化学家阿累尼乌斯的化学反应速率经验定律为:![]() ,(其中,k为速率常数,A、R为常数,Ea为活化能,T为绝对温度,e为自然对数底数,约为2.718)。由此判断下列说法中正确的是_____(填序号,k正 、k逆为正、逆速率常数)。
,(其中,k为速率常数,A、R为常数,Ea为活化能,T为绝对温度,e为自然对数底数,约为2.718)。由此判断下列说法中正确的是_____(填序号,k正 、k逆为正、逆速率常数)。
A.其他条件不变,升高温度,k正增大,k逆变小
B.其他条件不变,使用催化剂,k正、k逆同倍数增大
C.其他条件不变,増大反应物浓度k正增大,k逆不变
D.其他条件不变,减小压强,k正、k逆都变小
已知反应速率υ=υ正-υ逆=k正P(C2H5OH)·P(IB)-k逆P(ETBE),计算上图中M点![]() =_______(保留两位小数)
=_______(保留两位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,表中所列的字母分别代表一种化学元素。

(1)a、b、c三种元素的原子半径由大到小的顺序是___(填元素符号);b、f、h三种元素对应简单氢化物的热稳定性由强到弱的顺序是___(填化学式)。
(2)c、d、e三种元素最高价氧化物对应水化物中碱性最强的是___(填水化物的化学式)。
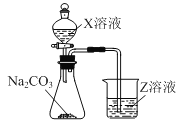
(3)利用如图装置可比较a、e、h的非金属性强弱,则装置中试剂X、Z分别为___(填化学式)。
(4)元素i的原子结构示意图为___;写出元素i的最高价氧化物对应水化物溶液与元素d的单质反应的离子方程式___。
(5)推测原子序数为34的元素在周期表中的位置___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验小组用酸性KMnO4溶液和草酸(H2C2O4)溶液反应,研究外界条件反应速率的影响,设计了如下探究实验方案:
实验 | 草酸溶液 (0.5mol/L) | 高锰酸钾 (0.5mol/L) | 稀硫酸 (0.5mol/L) | 硫酸锰 (0.5mol/L) | 温度 | 蒸馏水 |
① | 10.0 mL | 2.0 mL | 3.0 mL | 0 | 25℃ | 1.0 mL |
② | 10.0 mL | 2.0 mL | 3.0 mL | 1.0 mL | 25℃ | 0 |
③ | 8.0 mL | 2.0 mL | 3.0 mL | 0 | 25℃ | Vx |
④ | 10.0 mL | 2.0 mL | 3.0 mL | 0 | 35℃ | 1.0 mL |
回答下列问题:
(1)本方案中用于设计实验的化学反应的离子方程式是____,实验中预计通过观察什么现象或测定什么数据来进行判断:_____。
(2)该实验的目的是____。
(3)实验③中的Vx=____;实验①和④测得反应速率分别为v1、v4,则v1____v4(填:“>”“<”和“=”)
(4)实验①中,c(Mn2+)与t关系如图所示。AB段斜率明显大于OA段斜率,除反应可能放热外,猜想还可能是_____,利用提供的试剂设计实验III,验证猜想。
提供的试剂:0.01mol/L酸性KMnO4溶液,0.1 mol/L草酸溶液,3mol/L硫酸,MnSO4溶液,MnSO4固体,蒸馏水
①补全实验III的操作:向试管中先加入1mL 0.01mol/L酸性KMnO4溶液,再加入10滴3mol/L硫酸,然后加入少量的____,最后加入1mL 0.1 mol/L草酸溶液。
②若猜想成立,应观察到的实验现象是_______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
①向50mL小烧杯中加入20mL饱和FeCl3溶液并加热煮沸,制备氢氧化铁胶体
②家庭的厨卫管道内常因留有油脂、毛发、菜渣、纸棉纤维等而造成堵塞,此时可用固体管道疏通剂疏通,其主要成分为铝和氢氧化钠
③打印机(或复印机)使用的墨粉中的铁的氧化物是氧化铁
④“绿色化学”就是在生产结束后及时治理污染
⑤食品中适量添加二氧化硫可以达到去色、杀菌、抗氧化的作用
⑥对于可逆反应2HI(g)![]() H2(g) +I2(g) ΔH<0,若将反应体系降温至室温,反应正向移动,可以从温度分析对该平衡的影响
H2(g) +I2(g) ΔH<0,若将反应体系降温至室温,反应正向移动,可以从温度分析对该平衡的影响
A.②⑤⑥B.①③⑥C.②⑤D.③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铝( AlN)广泛应用于电子、陶瓷工业等领域。在一定条件下,AlN可通过如下反应制取:Al2O3+N2+3C![]() 2AlN+3CO。下列叙述正确的是( )
2AlN+3CO。下列叙述正确的是( )
A.AlN中氮的化合价为+3
B.AlN的摩尔质量为41 g
C.上述反应中,N2是氧化剂,Al2O3既不是氧化剂也不是还原剂。
D.上述反应中,每生成1 mol AlN需转移6 mol电子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com