
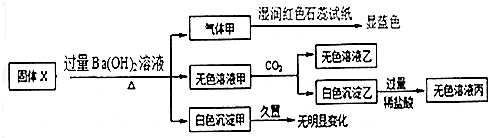
���� ��1��Ư�۵ijɷ�ΪCaCl2��Ca��ClO��2������ǿ�����Ե���Ca��ClO��2��
��2��ȡƯ��Һ����������3��5����ɫʯ����Һ��������Һ�ȱ���ɫ����ɫ����֪ʯ����Һ����������Һ�����ɫ��
��3��������ʯ����[Ca��OH��2]��Ӧ�����Ȼ��ơ�������ƺ�ˮ��
��4�����������ǿ�����ԣ��������������������ԭ��Ӧ��
��5����Ӧ��HClΪ��ԭ�����������������������ϼ���-1�����ߵ�0�ۣ�
��� �⣺��1��Ư�۵ijɷ�ΪCaCl2��Ca��ClO��2������ǿ�����Ե���Ca��ClO��2����Ư�۵���Ч�ɷ�ΪCa��ClO��2��
�ʴ�Ϊ��Ca��ClO��2��
��2��ȡƯ��Һ����������3��5����ɫʯ����Һ��������Һ�ȱ���ɫ����ɫ����֪ʯ����Һ����������Һ�����ɫ��˵�����м��Ժ������ԣ�
�ʴ�Ϊ��BC��
��3��������ʯ����[Ca��OH��2]��Ӧ�����Ȼ��ơ�������ƺ�ˮ���䷴Ӧ�ķ���ʽΪ��2Cl2+2Ca��OH��=CaCl2+Ca��ClO��2+2H2O��
�ʴ�Ϊ��2Cl2+2Ca��OH��=CaCl2+Ca��ClO��2+2H2O��
��4�����������ǿ�����ԣ��������������������ԭ��Ӧ����Ӧ��������������ƣ�Ӧ��������ƣ�
�ʴ�Ϊ������ȷ����Ϊ������ƣ�CaSO3������ǿ�Ļ�ԭ�ԣ��ᱻHClO������������ƣ�
��5����Ӧ��HClΪ��ԭ�����������������������ϼ���-1�����ߵ�0�ۣ���ת��0.2mol����ʱ���μӷ�Ӧ�Ļ�ԭ�������ʵ���ΪΪ0.2mol��
�ʴ�Ϊ��0.2mol��
���� ���⿼��Ư�۵ijɷ֡����ʼ��Ʊ���������ԭ��Ӧ��ע��������Ϣ�ṩ�ķ�Ӧ������������д��Ӧ�Լ����յ���ת�Ƶļ��㷽�������ػ���֪ʶ�Ŀ��飬��Ŀ�ѶȲ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����һ���Ǵ����� | |
| B�� | ��ɫ�����Ҳ�һ����Al��OH��3 | |
| C�� | ����X��һ������ ��NH4��2SO4��MgCl2��AlCl3 | |
| D�� | ����X��һ������FeCl2��AlCl3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��Na2O2�ĵ���ʽ
��Na2O2�ĵ���ʽ ��
��| �ǽ����� | ���Ӱ뾶 | ���ȶ��� | ���� |
| N��Cl | S2-��Na+ | NH3��H2O | H2SO4 ��HClO |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
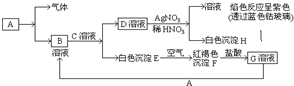 ��֪�����������ת������֪��A���������������Ľ������ʣ��Իش𣺣�1��д��E�Ļ�ѧʽFe��OH��2F�Ļ�ѧʽFe��OH��3��
��֪�����������ת������֪��A���������������Ľ������ʣ��Իش𣺣�1��д��E�Ļ�ѧʽFe��OH��2F�Ļ�ѧʽFe��OH��3���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��̼������ǽ��ܼ��ţ�ʹ��̫���ܵȴ��滯ʯȼ�ϣ��ɼ�������������ŷ� | |
| B�� | ����Դ���ŵ���Ҫ����Դ�ḻ����������û�л��������Ⱦ | |
| C�� | ���ܵ��ŵ���ֵ�ߡ���Դ�ḻ��ȼ�ղ�������Ⱦ��ȱ���Ǵ������������ | |
| D�� | �ߴ��ȵĹ赥�ʹ㷺�����������ά |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | BaCl2+K2SO4�TBaSO4��+2KCl | B�� | BaCO3+H2SO4�TBaSO4��+CO2��+H2O | ||
| C�� | Ba��NO3��2+H2SO4�TBaSO4��+2HNO3 | D�� | Ba��OH��2+2KHSO4�TBaSO4��+K2SO4+2H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com