
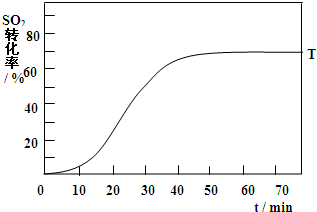
 黄铁矿(主要成分为FeS2)是工业制取硫酸的重要原料,其燃烧产物为SO2和Fe2O3.
黄铁矿(主要成分为FeS2)是工业制取硫酸的重要原料,其燃烧产物为SO2和Fe2O3.分析 (1)黄铁矿(主要成分为FeS2)其燃烧产物为SO2和Fe2O3,1g FeS2完全燃烧放出7.1kJ热量,480gFeS2完全燃烧放出3408kJ热量,机会热化学方程式书写;
(2)依据化学平衡三段式结合平衡常数=生成物浓度的幂次方之积比上反应物浓度的幂次方之积、转化率=$\frac{转化量}{起始量}$进行列式计算;
(3)欲使平衡向正反应方向移动且反应速率加快改变的条件需要增大反应物的浓度、增大压强等措施;注意温度降低平衡正向进行,但速率减小;
(4)反应是放热反应,温度升高,平衡逆向进行二氧化硫的转化率减小,但达到平衡所需要的时间缩短,据此画出曲线.
解答 解:(1)黄铁矿(主要成分为FeS2)其燃烧产物为SO2和Fe2O3,1g FeS2完全燃烧放出7.1kJ热量,480gFeS2完全燃烧放出3408kJ热量,反应的热化学方程式为:
4FeS2(s)+11O2(g)$\frac{\underline{\;高温\;}}{\;}$2Fe2O3(s)+8SO2(g)△H=-3408kJ/mol;
故答案为:4FeS2(s)+11O2(g)$\frac{\underline{\;高温\;}}{\;}$2Fe2O3(s)+8SO2(g)△H=-3408kJ/mol;
(2)将0.050molSO2(g)和0.030molO2(g)放入容积为1L的密闭容器中,反应:2SO2(g)+O2(g)?2SO3(g) 在一定条件下达到平衡,测得c(SO3)=0.040mol/L.依据平衡三段式列式计算;
2SO2(g)+O2(g)?2SO3(g)
起始量(mol/L) 0.05 0.03 0
变化量(mol/L) 0.04 0.02 0.04
平衡量(mol/L)0.01 0.01 0.04
平衡常数=$\frac{0.04{\;}^{2}}{0.01{\;}^{2}×0.01}$=1.6×103;
SO2的平衡转化率=$\frac{0.04mol/L}{0.05mol/L}$×100%=80%;
故答案为:1.6×103;80%;
(3)欲使平衡向正反应方向移动且反应速率加快;
A.向平衡混合物中充入Ar,容器中总压增加,分压不变,平衡不动,故A不符合;
B.向平衡混合物中充入O2,增大反应物的浓度平衡正向进行,反应速率增大,故B符合;
C.改变反应的催化剂,对平衡无影响,平衡不动,故C不符合;
D.降低反应的温度,反应速率减小,故D不符合;
故答案为:B;
(4)反应:2SO2(g)+O2(g)?2SO3(g)△H<0,SO2的转化率在起始温度T1=673K下随反应时间(t)的变化如下图,其他条件不变,仅改变起始温度为T2=723K,温度升高,平衡逆向进行,二氧化硫的转化率减小,但反应速率增大,达到平衡需要的时间短,在图中画出温度T2下SO2的转化率随反应时间变化的预期结果示意图如图所示;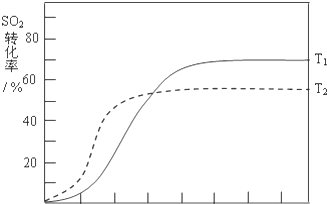
故答案为: .
.
点评 本题考查了热化学方程式书写方法,化学平衡的定量计算,平衡常数和转化率概念的应用,图象分析画法的分析应用,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 氯水能导电,所以氯水属于电解质 | |
| B. | Al(OH)3既能溶于盐酸又能溶于NaOH溶液,属于两性氢氧化物 | |
| C. | 能电离产生H+的化合物一定是酸 | |
| D. | 饱和溶液一定是浓溶液,不饱和溶液一定是稀溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100mL | B. | 200mL | C. | 300mL | D. | 400mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硅是酸性氧化物,不与任何酸反应 | |
| B. | 因为CO2通入水玻璃中可制得硅酸,说明碳酸的酸性比硅酸酸性强 | |
| C. | 水玻璃是一种矿物胶,黏性强,性质稳定,在空气中不易变质 | |
| D. | 石英玻璃是纯净物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有AgBr沉淀生成 | B. | 生成等物质的量的AgCl与AgBr沉淀 | ||
| C. | AgCl沉淀的物质的量少于AgBr | D. | AgCl沉淀的物质的量大于AgBr沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 体积减半,压强为原来的2倍 | |
| B. | 体积减半,压强大于原来的2倍 | |
| C. | 体积减半,压强增大,但小于原来的2倍 | |
| D. | 体积减半,达到平衡后,n(NO2)变为原来的一半 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该电池电解质在固态时,电池无法工作 | |
| B. | CO32- 在电池内部向正极移动 | |
| C. | CO在正极通入 | |
| D. | 当有22.4LCO参加反应时电路中有2mol电子发生转移 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com