
| A. | 3:2:2 | B. | 1:2:3 | C. | 1:3:3 | D. | 3:1:1 |
分析 根据Ba2++SO42-=BaSO4↓,相同的Ba2+恰好可使相同体积的三种溶液中的硫酸根离子完全转化为硫酸钡沉淀,由硫酸根离子的物质的量确定硫酸盐的物质的量,体积相同的溶液,溶质的物质的量之比等于盐溶液的摩尔浓度之比.
解答 解:由相同的Ba2+恰好可使相同体积的三种溶液中的硫酸根离子完全转化为硫酸钡沉淀,
则Ba2++SO42-=BaSO4↓,
1 1
SO42-~$\frac{1}{3}$Fe2(SO4)3~ZnSO4~K2SO4,
1 $\frac{1}{3}$ 1 1
又体积相同的溶液,溶质的物质的量之比等于盐溶液的摩尔浓度之比,
则三种硫酸盐溶液的摩尔浓度之比为$\frac{1}{3}$:1:1=1:3:3,
故选C.
点评 本题考查三种硫酸盐的浓度比的计算,明确发生的化学反应及硫酸根离子守恒是解答本题的关键,难度不大,不需要利用钡离子的物质的量代入计算.


科目:高中化学 来源: 题型:解答题
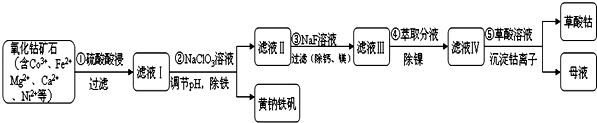
| 序号 | 矿石粒度/目 | 钴浸出率/% |
| 1 | -60 | 9.8 |
| 2 | -120 | 25.5 |
| 3 | -200 | 41.18 |
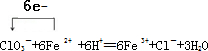 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(ClO-)=1.0 mol•L-1的溶液:Na+、SO32-、NO3-、SO42- | |
| B. | 0.1 mol•L-1Na2S溶液:SO42-、K+、Cl-、Cu2+ | |
| C. | 0.1 mol•L-1AgNO3 溶液:H+、K+、SO42-、Br- | |
| D. | 0.1 mol•L-1NaAlO2 溶液:OH-、Na+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 液480mL.
液480mL.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 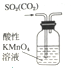 装置,除去SO2中混有的CO2 | |
| B. |  装置,用于亚硫酸钠和硫酸反应制取少量的SO2 | |
| C. | 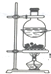 装置,分离NH4Cl和Ca(OH)2固体 | |
| D. | 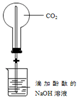 装置,做喷泉实验 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若Zn和MnO2都是足量的,则前一反应中盐酸全部被还原,后一反应中盐酸部分被氧化 | |
| B. | 两个都是氧化还原反应 | |
| C. | 盐酸都是被还原 | |
| D. | 等物质的量的Zn和MnO2分别与足量的浓盐酸反应,转移的电子数相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com