
| A. | 目前加碘食盐主要添加的是KIO3 | |
| B. | 盐卤可用于制豆腐 | |
| C. | 明矾可用于水的杀菌,消毒 | |
| D. | 在空气质量日报中SO2含量属于空气污染指数 |
 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 澄清透明的溶液中:Cu2+、Fe3+、NO3-、Cl- | |
| B. | 使甲基橙变红色的溶液:Fe2+、K+、NO3-、SO42- | |
| C. | 含有大量ClO-的溶液中:K+、OH-、I-、SO32- | |
| D. | 由水电离产生的c(H+)=10-12mol•L-1的溶液:NH4+、SO42-、HCO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
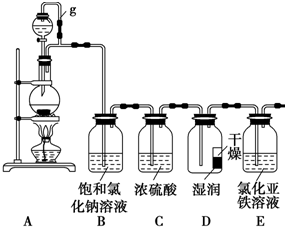 某探究小组为探究氯气的性质,设计了如下实验装置.请回答下列问题:
某探究小组为探究氯气的性质,设计了如下实验装置.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 体积相等,密度相等的CO和C2H4 | B. | 温度相同,体积相同的O2和N2 | ||
| C. | 质量相等,密度不等的N2和CO | D. | 压强相同、体积相同的N2和O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 应量取浓盐酸体积/mL | 应选用容量瓶的规格 | 除容量瓶、小烧杯、玻璃棒、胶头滴管外还需要的其它玻璃仪器 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某同学欲配制4mol•L-l的硫酸,但实验室只有三种不同浓度的硫酸:
某同学欲配制4mol•L-l的硫酸,但实验室只有三种不同浓度的硫酸:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com