
【题目】(1)K2FeO4是一种重要的净水剂,可用下列方法制得:2Fe(OH)3+3Cl2+10KOH=2K2FeO4+6KCl+8H2O,在该反应中,还原剂是________________。当反应中有1molK2FeO4生成时,消耗的Cl2在标况下的体积为_______________ ,转移电子的数目为________________。
(2)宇航员常用过氧化钠作供氧剂,写出过氧化钠与二氧化碳反应的化学方程式____________
(3)厨房里小苏打常作面包和糕点的发泡剂,写出小苏打溶于水的电离方程式:______________
(4)将钠、镁、铝各0.3mo1分别放入100mL1mol·L-1的盐酸中,同温同压下产生的气体体积比是________________
(5)现有①铝 ②SiO2 ③熔融NaCl ④稀硫酸 ⑤KOH固体 ⑥FeSO4溶液 ⑦NH3 ⑧新制备的氢氧化铁胶体分散系 ⑨HCl ⑩Na2O2上述物质属于非电解质的有___________(填序号)
【答案】Fe(OH)3 33.6L 3mol 2Na2O2+2CO2=2Na2CO3+O2 NaHCO3=Na++HCO3- 3:1:1 ②⑦
【解析】
(1)根据反应中元素化合价变化判断还原剂,计算转移电子数目,根据气体摩尔体积计算气体体积;
(2)根据过氧化钠的化学性质书写相关反应方程式;
(3)根据电离方程式书写规则书写相关电离方程式;
(4)根据金属与酸或水反应的方程式及物质的量与气体体积的的关系进行相关计算;
(5)根据电解质与非电解质的概念分析解答。
(1)反应中,Fe元素化合价由Fe(OH)3中+3价升高为K2FeO4中的+6价,则Fe(OH)3被氧化,作还原剂;1molK2FeO4生成时,消耗3/2molCl2,在标准状态下,体积为3/2mol×22.4L/mol=33.6L;转移的电子数为1mol×(6-3)=3mol,即3NA,故答案为:Fe(OH)3;33.6L;3mol;
(2)过氧化钠是供氧剂,与二氧化碳反应生成碳酸钠和氧气,反应方程式为:2Na2O2+2CO2=2Na2CO3+O2,故答案为:2Na2O2+2CO2=2Na2CO3+O2;
(3)小苏打是指NaHCO3,属于酸式盐,在水溶液中电离分两步,第一步完全电离生成钠离子和碳酸氢钠,第二步部分电离,所以电离方程式为:NaHCO3=Na++HCO3-,故答案为:NaHCO3=Na++HCO3-;
(4)钠和稀盐酸、水都反应,镁和铝分别与稀盐酸反应方程式为Mg+2HCl=MgCl2+H2↑、2Al+6HCl=2AlCl3+3H2↑,0.3molMg、Al完全反应需要盐酸的物质的量分别是0.6mol、0.9mol,实际上n(HCl)=1mol/L×0.1L=0.1mol,所以镁和铝都剩余,根据2Na~H2↑可知,0.3molNa完全反应,生成氢气的物质的量=0.3mol×1/2=0.15mol;镁和铝都剩余,所以二者与酸反应生成氢气的量相等,生成根据氢原子守恒得生成氢气的量=![]() ,所以同温同压下产生的气体的物质的量之比=0.15mol:0.05mol:0.05mol=3:1:1,故答案为:3:1:1;
,所以同温同压下产生的气体的物质的量之比=0.15mol:0.05mol:0.05mol=3:1:1,故答案为:3:1:1;
(5)在水溶液中和熔融状态下均不能导电的化合物为非电解质,上述物质中属于非电解质的是②SiO2与⑦NH3,故答案为:②⑦。


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:
【题目】NaNO2可用作食品添加剂。测定粗产品中NaNO2的含量。称取m g粗产品,溶解后配制成250 mL溶液。取出25.00mL溶液,用cmolL-1酸性KMnO4溶液平行滴定三次,平均消耗的体积为V mL。
已知:2MnO4-+6H+ +5NO2-=5NO3-+2Mn2++3H2O
(1)配制溶液时,需使用的玻璃仪器除烧杯、玻璃棒外,还有___(填字母)。
A. 250 mL容量瓶 B. 量筒 C. 胶头滴管 D. 锥形瓶
(2)用____(填“酸式”或“碱式”)滴定管盛放高锰酸钾溶液。
(3)该实验___(填“需要”或“不需要”)加入指示剂。当观察到___时,滴定达到终点。
(4)粗产品中NaNO2的质量分数为____(用代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,关闭活塞,向甲、乙两刚性密闭容器中分别充入1molA、2molB,此时甲、乙的容积均为2L(连通管体积忽略不计)。在T℃时,两容器中均发生下述反应:A(g)+2B(g)![]() 2C(g)+3D(g)△H<0。达平衡时,乙的体积为2.6L,下列说法正确的是( )
2C(g)+3D(g)△H<0。达平衡时,乙的体积为2.6L,下列说法正确的是( )
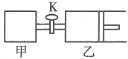
A. 甲中反应的平衡常数小于乙
B. 当乙中A与B的体积分数之比为1:2时,反应达到平衡状态
C. 平衡时甲容器中A的物质的量小于0.55mol
D. 若打开活塞K,达平衡时乙容器的体积为3.2L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学科研小组研究在其他条件不变时,改变某一条件对A2(g)+3B2(g)![]() 2AB2(g)化学平衡状态的影响,得到如右图所示的变化规律(图中T表示温度,n表示物质的量),据此可得出的判断结论不正确的是 ( )
2AB2(g)化学平衡状态的影响,得到如右图所示的变化规律(图中T表示温度,n表示物质的量),据此可得出的判断结论不正确的是 ( )
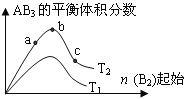
A. 达到平衡时A2的转化率大小为:b>a
B. a、b、c三点的平衡常数相同
C. 若T2>T1,则正反应一定是吸热反应
D. b点时,平衡体系中A、B原子数之比一定是1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】感光性高分子又称为“光敏性高分子”,是一种在彩电荧光屏及大规模集成电路制造中应用较广的新型高分子材料,其结构简式为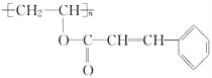 。
。
试回答下列问题:
(1)该物质的单体是______。
(2)在一定条件下,该高聚物可发生的反应有__________(填序号)。
①加成反应 ②氧化反应 ③取代反应 ④酯化反应
(3)该高聚物在催化剂的作用下,水解后得到相对分子质量较小的产物为A,则:
①A的分子式是_____。
②A在一定条件下与乙醇反应的化学方程式是________。
③A的同分异构体有多种,其中含有苯环、![]() 和
和![]() ,且苯环上有两个对位取代基的结构简式是_______、______。
,且苯环上有两个对位取代基的结构简式是_______、______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:
(1)CH3COOH(l)+2O2(g) == 2CO2(g)+2H2O(l) ΔH1=-870.3 kJ·mol-1
(2)C(s)+ O2(g) == CO2(g) △H2=-393.5 kJmol-1
(3)H2(g) +![]() O2(g) == H2O(l) △H3=-285.8kJ·mol-1
O2(g) == H2O(l) △H3=-285.8kJ·mol-1
则反应2C(s)+2H2(g) +O2(g) == CH3COOH(l)的△H为( )
A. -488.3 kJ·mol-1 B. -244.15 kJ·mol-1 C. +488.3 kJ·mol-1 D. +244.15 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在如图所示的三个容积相同的容器①②③中进行如下反应:3A(g)+B(g) ![]() 2C(g) ΔH<0,若起始温度相同,分别向三个容器中通入3 mol A和1 mol B,则达到平衡时各容器中C物质的体积分数由大到小的顺序为( )
2C(g) ΔH<0,若起始温度相同,分别向三个容器中通入3 mol A和1 mol B,则达到平衡时各容器中C物质的体积分数由大到小的顺序为( )
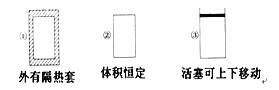
A. ③②①B. ③①②C. ①②③D. ②①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上通常利用SiO2 和碳反应来制取硅,写出反应的化学方程式___________________。
工业上还可以利用镁制取硅,反应为2Mg+SiO2 = 2MgO+Si,同时会发生副反应:2Mg + Si = Mg2Si。如图是进行Mg与SiO2反应的实验装置,试回答下列问题:

(1)由于O2和H2O(g)的存在对该实验有较大影响,实验中应通入气体X作为保护气,试管中的固体药品可选用________(填序号)。
a.石灰石 b.锌粒 c.纯碱
(2)实验开始时,必须先通一段时间X气体,再加热反应物,其理由是 ___________________________;当反应引发后,移走酒精灯,反应能继续进行,其原因是______________________。
(3)反应结束后,待冷却至常温时,往反应后的混合物中加入稀盐酸,可观察到闪亮的火星,产生此现象的原因是副产物Mg2Si遇盐酸迅速反应生成SiH4(硅烷)气体,然后SiH4自燃.用化学方程式表示这两个反应①________________________②___________________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com