
| A. | 硅酸钠溶液与醋酸溶液混合:SiO32-+2H+=H2SiO3↓ | |
| B. | NH4Al(SO4)2溶液与过量稀氨水反应:Al3++3NH3•H2O=Al(OH)3↓+3NH4+ | |
| C. | 用稀硝酸清洗试管内壁的银镜:Ag+2H++NO3-=Ag++NO2↑+H2O | |
| D. | FeBr2溶液中通入过量Cl2:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- |
分析 A.醋酸在离子反应中保留化学式;
B.只有铝离子与氨水反应生成氢氧化铝沉淀;
C.反应生成硝酸银、NO和水;
D.氯气过量,亚铁离子、溴离子均被氧化.
解答 解:A.硅酸钠溶液与醋酸溶液混合的离子反应为SiO32-+2CH3COOH=H2SiO3↓+2CH3COO-,故A错误;
B.NH4Al(SO4)2溶液与过量稀氨水反应的离子反应为Al3++3NH3•H2O=Al(OH)3↓+3NH4+,故B正确;
C.用稀硝酸清洗试管内壁的银镜的离子反应为3Ag+4H++NO3-=3Ag++NO↑+2H2O,故C错误;
D.FeBr2溶液中通入过量Cl2的离子反应为2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-,故D错误;
故选B.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重氧化还原反应、与量有关的离子反应考查,综合性较强,题目难度不大.


科目:高中化学 来源: 题型:解答题
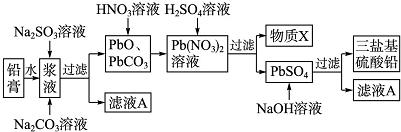
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,pH=13的1.0 L Ba(OH)2溶液中含有的OH-数目为0.2NA | |
| B. | 100 mL 1 mol•L-1的H2SO4溶液中含有0.1NA个H+ | |
| C. | 将4 g NaOH溶于100 g蒸馏水中,所得溶液物质的量浓度是0.1 mol•L-1 | |
| D. | 20g重水(D2O)所含的电子数为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向水中加入少量固体硫酸氢钠,恢复原温度时,c(H+)增大,Kw变大 | |
| B. | 体积、pH均相同的醋酸和盐酸完全溶解等量的镁粉(少量),后者用时少 | |
| C. | 0.1 mol.L-1的醋酸溶液加水稀释,$\frac{c({H}^{+})}{c(O{H}^{-})}$减小 | |
| D. | 常温下,V1LpH=11的NaOH溶液与V2LpH=3的HA溶液混合,若混合液显中性,则V1≤V2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
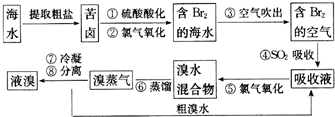
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
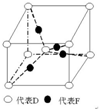 在元素周期表前四周期中原子序数依次增大的六种元素A、B、C、D、E、F中,A与其余五种元素既不同周期也不同主族,B的一种核素在考古时常用来鉴定一些文物的年代,C的氧化物是导致酸雨的主要物质之一,D原子核外电子有8种不同的运动状态,E的基态原子在前四周期元素的基态原子中单电子数最多,F元素的基态原子最外能层只有一个电子,其它能层均已充满电子.
在元素周期表前四周期中原子序数依次增大的六种元素A、B、C、D、E、F中,A与其余五种元素既不同周期也不同主族,B的一种核素在考古时常用来鉴定一些文物的年代,C的氧化物是导致酸雨的主要物质之一,D原子核外电子有8种不同的运动状态,E的基态原子在前四周期元素的基态原子中单电子数最多,F元素的基态原子最外能层只有一个电子,其它能层均已充满电子. ; A2D由液态形成晶体时密度减小(填增大,不变或减小),分析主要原因(用文字叙述)水形成晶体时,每个水分子与4个水分子形成氢键,构成空间正四面体网状结构,水分子空间利用率低,密度反而减小.
; A2D由液态形成晶体时密度减小(填增大,不变或减小),分析主要原因(用文字叙述)水形成晶体时,每个水分子与4个水分子形成氢键,构成空间正四面体网状结构,水分子空间利用率低,密度反而减小.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
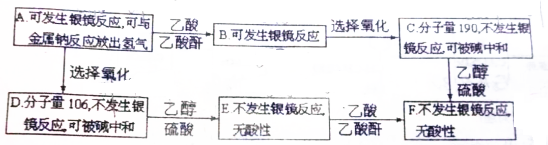
 .
.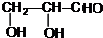 +2Ag(NH3)2OH$\stackrel{△}{→}$
+2Ag(NH3)2OH$\stackrel{△}{→}$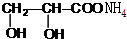 +2Ag↓+3NH3+H2O.
+2Ag↓+3NH3+H2O.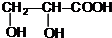 +CH3CH2OH$→_{△}^{浓硫酸}$
+CH3CH2OH$→_{△}^{浓硫酸}$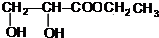 +H2O,属于取代反应(填反应类型).
+H2O,属于取代反应(填反应类型).查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 非金属之间形成的化学键一定是共价键 | |
| B. | 在共价化合物中不可能含有离子键 | |
| C. | 只含有共价键的物质一定是共价化合物 | |
| D. | 含有离子键的化合物一定是离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

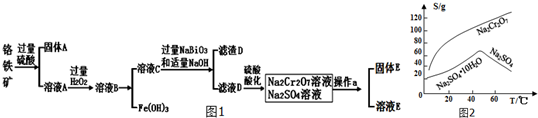
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com