
| 序号 | ① | ② | ③ | ④ | ⑤ | ⑥ |
| 仪 器 及 装 置 图 |  |  |  |  |  |  |
分析 利用实验室制得的氯气与铜反应制取纯净氯化铜,因实验室制得的氯气中混有氯化氯和水汽,需要除去后得到干燥的氯气再与铜在加热的情况下反应,为了得到纯净的氯化铜,在加热反应前需要将装置内的空气排出,形成无氧环境,同时要考虑氯气的尾气对环境有污染,需要用氢氧化钠溶液除去;
(1)仪器的连接方法:先制备反应物,然后除杂质,再使氯气与铜反应,最后尾气处理;进行气体除杂或者干燥时,连接顺序一般是:“长进短出”的原则,根据题中实验原理,用浓盐酸与二氧化锰反生成氯气,除杂后与铜反应生成氯化铜,尾气用氢氧化钠吸收,据此答题;
(2)因需要干燥的氯气与铜反应,故利用浓硫酸对氯气进行干燥处理;
(3)氯气中混有氯化氢气体,可利用饱和食盐水除去;
(4)装置⑥是尾气处理,吸收多余的氯气,氯气与氢氧化钠反应生成氯化钠和次氯酸钠,根据电荷守恒书写离子方程式;
(5)实验中涉及气体的,实验开始时一般都要检验装置气密性,为了防止空气中的成分的干扰,实验结束时,有铜粉的装置中还应再能一会儿氯气;
(6)装置⑤是实验室制取氯气,在烧瓶中发生反应的是浓盐酸和二氧化锰,可写出此反应的化学方程式.
解答 解:(1)仪器的连接方法:先制备反应物,然后除杂质,再使氯气与铜反应,最后尾气处理;进行气体除杂或者干燥时,连接顺序一般是:“长进短出”的原则,根据题中实验原理,用浓盐酸与二氧化锰反生成氯气,除杂后与铜反应生成氯化铜,尾气用氢氧化钠吸收,所以仪器连接顺序为:③⑤④②①⑥,故答案为:③⑤④②①⑥;
(2)装置②中盛装的是浓硫酸,可利用此装置干燥氯气,故答案为:干燥氯气;
(3)饱和食盐水可以除去氯气中的氯化氢,故答案为:除去氯气中混有的氯化氢;
(4)装置⑥中氯气与氢氧化钠反应生成氯化钠和次氯酸钠,反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O,故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
(5)实验中涉及气体的,实验开始时一般都要检验装置气密性,为了防止空气中的成分的干扰,实验结束时,有铜粉的装置中还应再通一会儿氯气至硬质玻璃管冷却,所以实验结束时,应先熄灭①处的酒精灯,故答案为:检验装置气密性;①;
(6)装置⑤是利用二氧化锰和浓盐酸混合加热制氯气,发生反应的化学方程式为MnO2+4HCl$\frac{\underline{\;加热\;}}{\;}$MnCl2+Cl2↑+2H2O,故答案为:MnO2+4HCl$\frac{\underline{\;加热\;}}{\;}$MnCl2+Cl2↑+2H2O.
点评 本题考查了常见气体的制取和收集及实验的注意事项,氯化铁的性质和制取;关键是掌握其选择的依据及原理,在装置的分析中明确装置的特点及其作用,难度较大.


 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:选择题
| A. | 漂白粉可长期放置在烧杯中 | |
| B. | 金属钠燃烧时不能用水灭火,应该用沙子灭火 | |
| C. | 氯水可以用无色透明的试剂瓶装保存 | |
| D. | 实验后剩余的钠不可放回原试剂瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)根据最新“人工固氮”的研究报道,在常温常压和光照条件下N2在催化剂表面与水发生反应:
(1)根据最新“人工固氮”的研究报道,在常温常压和光照条件下N2在催化剂表面与水发生反应:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
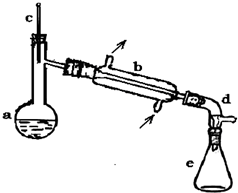 醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应
醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应 和实验装置如图:
和实验装置如图:| 相对分子质量 | 密度/(g?cm-3 ) | 沸点/℃ | 溶解性 | |
| 环己醇 | 100 | 0.9618 | 161 | 微溶于水 |
| 环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 活性炭、氯气都能使品红溶液褪色 | |
| B. | 苯、乙醇、纤维素都能与浓硝酸反应 | |
| C. | 乙烯、氯乙烯都能使溴水褪色 | |
| D. | 淀粉、蛋白质都能发生显色(或颜色)反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com